题目内容
6.金属单质及其化合物与工农业生产、日常生活有密切的联系.请回答下列问题: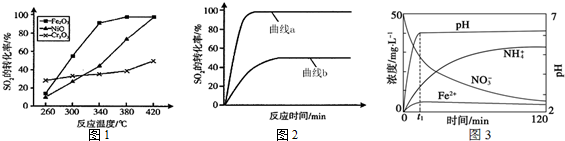
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
2CO(g)+SO2(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)△H=-270KJ.mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择c为该反应的催化剂较为合理.(选填序号)
a.Cr2O3 b.NiO c.Fe2O3
选择该催化剂的理由是:Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源.
某科研小组用选择的催化剂,在380℃时,研究了n(CO):n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图2).则图2中表示n(CO):n(SO2)=3:1的变化曲线为a.
(2)科研小组研究利用铁屑除去地下水中NO3-的反应原理.
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图3(部分副反应产物曲线略去).请根据图中信息写出t1时刻前发生反应的离子方程式4Fe+NO3-+10H+=4Fe2++NH4++3H2O;t1时刻后,反应仍在进行,溶液中NH${\;}_{4}^{+}$的浓度在增大,Fe2+的浓度却没有明显变化,可能的原因是t1后溶液pH较大,Fe2+水解生成Fe(OH)2.
②若在①的反应中加入活性炭,可以提高除去NO3-的效果,其原因可能是活性炭和铁构成了原电池,加快反应速率.正常地下水中含有CO32-,会影响效果,其原因有:a.生成FeCO3沉淀覆盖在反应物的表面,阻止了反应的进行;b.CO32-消耗H+,溶液酸性减弱,效果降低.
(3)LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车.电池反应为:FePO4+Li$?_{充电}^{放电}$LiFePO4
PO4,负极材料是石墨,含Li+导电固体为电解质.放电时电池正极反应为FePO4+Li++e-=LiFePO4.
分析 (1)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;
n(CO):n(SO2)越大,二氧化硫的转化率越大;
(2)①根据图示可知,t1时刻前,NO3-、H+浓度逐渐减小,是Fe与硝酸反应生成Fe2+、NH4+与水;
t1后溶液pH较大,Fe2+水解生成Fe(OH)2,溶液中Fe2+浓度没有明显变化;
②活性炭和铁构成了原电池,加快反应速率; CO32-消耗H+,溶液酸性减弱;
(3)负极材料是石墨,含Li+导电固体为电解质,放电时电池正极发生还原反应,FePO4获得电子,与Li+结合生成LiFePO4.
解答 解:(1)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,故选Fe2O3作催化剂,n(CO):n(SO2)越大,二氧化硫的转化率越大,故曲线a表示n(CO):n(SO2)=3:1的变化曲线,
故答案为:c;Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;a;
(2)①根据图示可知,t1时刻前,NO3-、H+浓度逐渐减小,是Fe与硝酸反应生成Fe2+、NH4+与水,反应离子方程式为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
t1后溶液pH较大,Fe2+水解生成Fe(OH)2,溶液中Fe2+浓度没有明显变化,
故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;t1后溶液pH较大,Fe2+水解生成Fe(OH)2;
②活性炭和铁构成了原电池,加快反应速率,可以提高除去NO3-的效果,CO32-消耗H+,溶液酸性减弱,效果降低,
故答案为:活性炭和铁构成了原电池,加快反应速率;CO32-消耗H+,溶液酸性减弱,效果降低;
(3)负极材料是石墨,含Li+导电固体为电解质,放电时电池正极发生还原反应,FePO4获得电子,与Li+结合生成LiFePO4,正极电极反应式为:FePO4+Li++e-=LiFePO4,
故答案为:FePO4+Li++e-=LiFePO4.
点评 本题考查化学平衡计算与影响因素、原电池等,侧重考查学生读图及阅读获取信息能力,是对学生综合能力的考查,难度中等.

| A. | H2O的相对分子质量是18克 | |
| B. | H2O的摩尔质量是18克 | |
| C. | 标准状况下H2O的摩尔体积是22.4L.mol-1 | |
| D. | 1mol H2O的质量是18克 |
时间 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | T | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
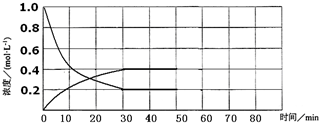
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子间相互结合,也可以使原子间相互结合 | |
| C. | 化学反应过程中反应物化学键断裂,生成物化学键形成 | |
| D. | 氯化钠固体溶于水没有新物质生产,故没有破坏化学键 |
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | - |
| (2) | 0.1mol | 0.3mol | - | 0.2mol |
| A. | Cl-的物质的量相同 | B. | SO42-的数目相同 | ||
| C. | K+的数目相同 | D. | Zn2+的物质的量不同 |
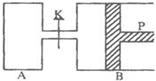 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应: