题目内容
12.下列实验操作正确且能达到实验目的都是( )| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
分析 A.反应后的混合物与水混合的顺序错误;
B.根据反应现象可判断浓硫酸的性质;
C.氢氧化亚铁易被氧气氧化;
D.Cu2(OH)2C03能溶于盐酸.
解答 解:A.铜丝与浓硫酸加热生成硫酸铜后,再把混合物加入水中形成硫酸铜溶液,而不能把水加入反应混合物中,防止剩余的浓硫酸稀释时溅出,故A错误;
B.向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀.再加入少许浓硫酸,迅速搅拌,可观察到蔗糖碳化而变黑,可说明浓硫酸具有脱水性,故B错误;
C.制氢氧化亚铁导管插入液面下防止被氧化,故C错误;
D.Cu2(OH)2C03能溶于盐酸,所以能用盐酸除去铜绿,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及铜及其化合物的性质、氧化还原反应以及浓硫酸的性质,侧重于考查学生化学实验方案的评价能力和实验操作能力,注意把握实验原理和实验注意事项,题目难度不大.

练习册系列答案
相关题目
8.下列发展中的化学电源中不属于充电电池的是( )
| A. | 铅蓄电池 | B. | 锂离子电池 | C. | 锌锰电池 | D. | 镍镉电池 |
3.溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如图:
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:
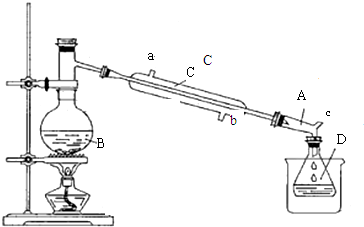
实验中可能用到的数据如下表:
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物.
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:

实验中可能用到的数据如下表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
17.氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的是( )
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
1.关于下列四个图象的说法正确的是( )

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
2.下列说法正确的是( )
| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |