4.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素X与Z、Y 与W形成的化合物都为离子化合物 | |
| B. | 元素X与Y,Z与Y形成的二元化合物都只有一种 | |
| C. | Y、Z、W三种元素形成的离子半径随原子序数的增加而增大 | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
3.下列有关化学用语或说法正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: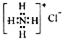 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
2.下列说法正确的是( )
| A. | 实验测得石墨(s)、金刚石(s)的燃烧热△H(kJ•mol-1)分别为-393.5、-395.0, 则C(s石墨)═C(s金刚石)△H=+1.5kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ/mol | |
| C. | 在某些化学反应使用催化剂能改变该反应的焓变 | |
| D. | 吸热反应一定需要加热才能使反应进行 |
1.工业生产水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.4kJ•mol-1下列判断正确的是( )
| A. | 反应物的能量总和大于生成物的能量总和 | |
| B. | 上述反应表示生成1体积CO(g)吸收131.4kJ热量 | |
| C. | 在CO(g)+H2(g)═C(s)+H2O(l) 中的△H比-131.4kJ•mol-1小 | |
| D. | C(s)+2H2O(g)═CO2(g)+2H2(g) 中的△H比+131.4kJ•mol-1小 |
20.下列物质的性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 酸性强弱:HClO4>HBrO4>HIO4 | ||
| C. | 碱性强弱:Ba(OH)2>Sr(OH)2>Ca(OH)2 | D. | 非金属性强弱:Cl>Se>Br |
19.下列关于碱金属的主要性质说法正确的是( )
| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
18.下列关于F、Cl、Br、I的性质的比较,说法错误的是( )
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
15.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性.下列有关分析正确的是( )
0 171863 171871 171877 171881 171887 171889 171893 171899 171901 171907 171913 171917 171919 171923 171929 171931 171937 171941 171943 171947 171949 171953 171955 171957 171958 171959 171961 171962 171963 171965 171967 171971 171973 171977 171979 171983 171989 171991 171997 172001 172003 172007 172013 172019 172021 172027 172031 172033 172039 172043 172049 172057 203614
| A. | K3C60中只有离子键 | B. | K3C60中碳元素显-3价 | ||
| C. | C60与12C互为同素异形体 | D. | 该晶体在熔融状态下能导电 |
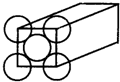 金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,Au的摩尔质量为197g/mol.求:
金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,Au的摩尔质量为197g/mol.求: