题目内容
18.下列关于F、Cl、Br、I的性质的比较,说法错误的是( )| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
分析 F、Cl、Br、I位于周期表同一主族,原子序数逐渐增大,原子核外电子层数逐渐增加,半径逐渐增大,熔沸点随核电荷数的增加而增加;元素的非金属性逐渐减弱,则对应氢化物的稳定性质逐渐减弱,但颜色逐渐加深.
解答 解:A、卤族元素单质从F到I,其颜色分别为:淡黄绿色、黄绿色、深红棕色、紫红色,所以卤族元素单质的颜色随着核电荷数增大而加深,故A正确;
B、F、Cl、Br、I位于周期表同一主族,它们的熔沸点随核电荷数的增加而增加,故B正确;
C、元素的非金属性越强,其气态氢化物的稳定性越强,从F到I,其非金属性随着核电荷数增大而减弱,所以其气态氢化物的稳定性逐渐减弱,故C正确;
D、元素的非金属性越强,离子的还原性越弱,从F到I,其非金属性随着核电荷数增大而减弱,所以它们的气态氢化物的还原性随核电荷数的增加而增强,故D错误.
故选D.
点评 本题考查了卤族元素结构和性质的关系,结构决定性质,根据结构分析其性质,熟练掌握元素周期律知识,题目难度不大.

练习册系列答案
相关题目
6.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2═LiNH2+LiH下列说法正确的是( )
| A. | 亚氨基锂(Li2NH)中N的化合价为-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | Li+和H-的半径相同 | |
| D. | 该反应中氢气既是氧化剂又是还原剂 |
13.分子晶体中如果不是由于分子本身形状的影响,它的晶体将取密堆积结构,原因是分子晶体中( )
| A. | 分子间作用力无一定方向性 | B. | 占据晶格结点的微粒是原子 | ||
| C. | 化学键是共价键 | D. | 三者都是 |
3.下列有关化学用语或说法正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: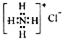 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
6.碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如图,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2.
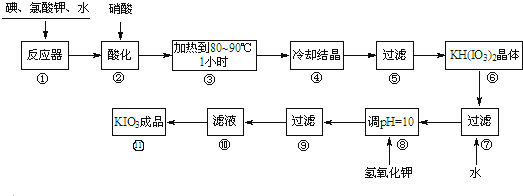
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为60e-;
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性,能将已生成的碘酸氢钾还原;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有漏斗、烧杯、玻璃;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:KOH+KH(IO3)2=2KIO3+H2O;
(6)参照下表碘酸钾的溶解度,步骤 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.

试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为60e-;
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性,能将已生成的碘酸氢钾还原;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有漏斗、烧杯、玻璃;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:KOH+KH(IO3)2=2KIO3+H2O;
(6)参照下表碘酸钾的溶解度,步骤
 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
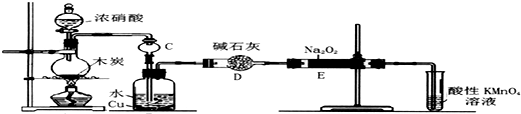
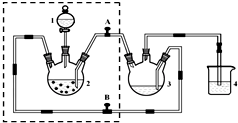 醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: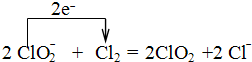 .
.