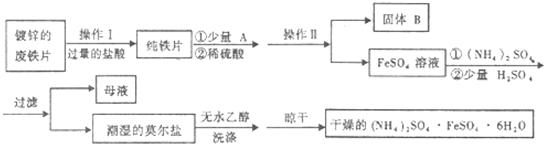
题目内容
15.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性.下列有关分析正确的是( )| A. | K3C60中只有离子键 | B. | K3C60中碳元素显-3价 | ||
| C. | C60与12C互为同素异形体 | D. | 该晶体在熔融状态下能导电 |
分析 K3C60为离子化合物,晶体中含有离子键和共价键,在熔融状态下能导电,结合同素异形体的概念解答该题.
解答 解:A、K3C60中中K+与C603-之间为离子键,C603-中C-C键为共价键,故A错误;
B、K3C60中钾离子显+1价、C603-整体显-3价,故B错误;
C、C60为单质,12C为原子,而同素异形体为同种元素形成的不同单质,二者不属于同素异形体,故C错误;
D、K3C60为离子化合物,在熔融状态下能导电,故D正确.
故选:D.
点评 本题考查晶体的知识,题目难度不大,解答本题关键是要把握离子化合物的组成,学习中注意同素异形体与同位素的关系.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
3.把一黄豆粒大小的金属钠投入盛有CuSO4溶液的烧杯里,不可能观察到的现象是( )
| A. | 钠熔化,浮在液面上四处游动 | B. | 有气体产生 | ||
| C. | 溶液中产生蓝色絮状沉淀 | D. | 溶液中析出红色的铜 |
10.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉能完全溶于足量硝酸中,得到澄清透明溶液 | |
| C. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| D. | 1 mol青石棉能还原1 mol HNO3的稀硝酸 |
20.下列物质的性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 酸性强弱:HClO4>HBrO4>HIO4 | ||
| C. | 碱性强弱:Ba(OH)2>Sr(OH)2>Ca(OH)2 | D. | 非金属性强弱:Cl>Se>Br |
7.已知X、Y、Z、W为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | X与W形成的化合物中只含离子键 | |
| C. | W的氢化物的沸点一定高于Z的氢化物 | |
| D. | 若W与Y的原子序数相差5,则两者形成的化合物的化学式一定为Y2W3 |
4.如图所示的钢铁腐蚀中,下列说法正确的是( )


| A. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| B. | 钢铁被腐蚀的最终产物为FeO | |
| C. | 碳表面发生氧化反应 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
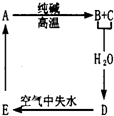 物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断:
物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断: