题目内容
17.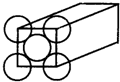 金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,Au的摩尔质量为197g/mol.求:
金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,Au的摩尔质量为197g/mol.求:(1)金晶体中最小的一个立方体含有4个金属原子.
(2)金的密度为19.36g•cm-3.
分析 (1)利用均摊法计算每个晶胞中含有的金原子个数;
(2)金晶胞是面心立方,所以每个金晶胞中含有的原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则金晶体的边长a=$\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$;再根据晶胞的边长计算其对角线长度,对角线长度就是金原子半径的4倍,半径已知,即可求出密度.
解答 解:(1)金晶胞是面心立方,所以每个金晶胞中含有的原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
(2)每个金晶胞中含有4个原子,金晶体的边长a=$\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$;对角线长度就是金原子半径的4倍,金原子半径为1.44×10-10 m=1.44×10-8 cm,再由晶胞的边长计算其对角线长度,所以a2+a2=(4r)2,即($\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$)2+($\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$)2=(1.44×10-8)2,所以密度ρ=19.36g•cm-3,
故答案为:19.36.
点评 本题考查晶胞的计算,明确晶胞体积与密度、相等原子质量的关系是解本题关键,难度较大,注意晶胞的边长不是金原子直径,为易错点.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
8.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 用Cu除去CuCl2溶液中的少量FeCl3:Cu+Fe3+═Cu2++Fe2+ |
5.下列对相等物质的量的C3H6和C2H4的比较中正确的是( )
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
| A. | ①和③ | B. | ②和③ | C. | ①和② | D. | ③和④ |
12.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 1mol甲烷在光照条件下最多能与89.6L氯气反应 | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: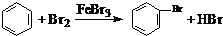 |
2.下列说法正确的是( )
| A. | 实验测得石墨(s)、金刚石(s)的燃烧热△H(kJ•mol-1)分别为-393.5、-395.0, 则C(s石墨)═C(s金刚石)△H=+1.5kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ/mol | |
| C. | 在某些化学反应使用催化剂能改变该反应的焓变 | |
| D. | 吸热反应一定需要加热才能使反应进行 |
6.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32?)+c(H2CO3)] | |
| B. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| C. | 0.1 mol•L-1Na2SO3溶液 c(H+)+c( Na+)=2c( SO32-)+c( OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |