题目内容
4.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )| A. | 元素X与Z、Y 与W形成的化合物都为离子化合物 | |
| B. | 元素X与Y,Z与Y形成的二元化合物都只有一种 | |
| C. | Y、Z、W三种元素形成的离子半径随原子序数的增加而增大 | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
分析 X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此进行判断.
解答 解:X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,
A.元素X与Z形成的化合物为NaH,Y与W形成的化合物为Al2O3,二者都属于离子化合物,故A正确;
B.H与O两种元素组成的化合物为H2O、H2O2,H与Na两种元素组成的化合物为Na2O、Na2O2,故B错误;
C.Y、Z、W元素形成的简单离子分别为O2-、Na+、Al3+,O2-、Na+、Al3+核外电子数都是10,具有相同电子层结构,半径随着核电荷数的增加而减小,所以离子半径O2->Na+>Al3+,故C错误;
D.元素W、R的最高价氧化物对应水化物分别为偏铝酸、硫酸,硫酸是强酸,偏铝酸属于弱酸,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的综合应用,题目难度中等,推断元素是解题关键,注意熟练掌握原子结构与元素周期律、元素周期表之间的关系.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2mol/l | B. | 4mol/l | C. | 1 mol/l | D. | 20mol/l |
| A. | 将钠在石棉网上加热熔化,冷却后得到淡黄色固体 | |
| B. | 食盐在无色的火焰上灼烧时,火焰呈黄色 | |
| C. | 久置的碘化钾溶液呈黄色 | |
| D. | 在氯化亚铁溶液中通入氯气,反应后得到黄色溶液 |
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 1mol甲烷在光照条件下最多能与89.6L氯气反应 | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: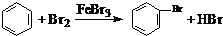 |
| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
| A. | 0.2 mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,17g甲基(-14CH3)所含的电子数为9NA | |
| D. | 在1 L 0.1 mol/L的碳酸钠溶液中,氧原子总数为0.3NA |
