题目内容
19.下列关于碱金属的主要性质说法正确的是( )| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
分析 A.钠的密度大于钾;
B.碱金属都具有良好的导电性、导热性,熔点低;
C.锂与氧气反应只生成氧化锂;
D.第ⅠA族元素单质的熔沸点逐渐降低;
解答 解:A.单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大,钠与钾反常,钠的密度大于钾,故A错误;
B.碱金属都具有良好的导电性、导热性,熔点低,故B正确;
C.锂与氧气反应只生成氧化锂,不会生成过氧化物,故C错误;
D.第ⅠA族元素单质的熔沸点逐渐降低,即在钠、钾、铷三种单质中,铷的熔点最低,故D错误;
故选:B.
点评 本题考查了碱金属的性质相似性和递变规律,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
14.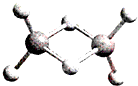 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )| A. | Al2H6在固态时所形成的晶体是分子晶体 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
4.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素X与Z、Y 与W形成的化合物都为离子化合物 | |
| B. | 元素X与Y,Z与Y形成的二元化合物都只有一种 | |
| C. | Y、Z、W三种元素形成的离子半径随原子序数的增加而增大 | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
8.下列叙述正确的是( )
| A. | 青铜、黄铜、碳素钢都属于合金 | |
| B. | 棉、麻、丝、有机玻璃都是天然高分子材料 | |
| C. | 糖类、油脂、蛋白质的组成元素完全相同 | |
| D. | 石英玻璃、陶瓷和水泥都是硅酸盐产品 |
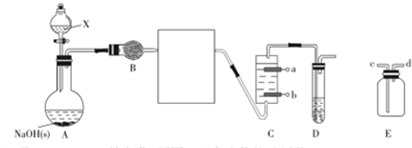
7.乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用下图装置制取乙醚和乙烯.

有关物质沸点数据
(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
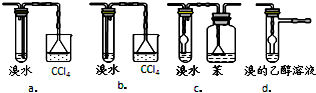
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.
⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:
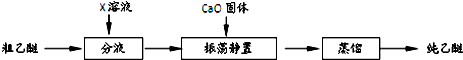
(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).

有关物质沸点数据
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.

⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).