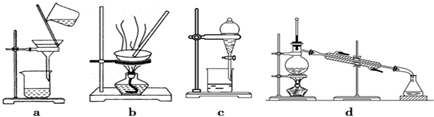
15.测定Cu(NO3)2•nH2O的结晶水含量,下列方案中不可行的是( )
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| C. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO | |
| D. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
14.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的阴离子的结构示意图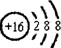 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
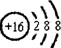 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
12.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | $\frac{1}{2}$C(s)+O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | HCl(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H1; H2(g)+Cl2(g)=2HCl(g)△H2 |
11.已知断裂1molC-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:
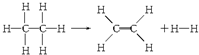
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
10.与图象有关的叙述,正确的是( )
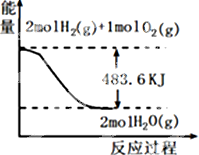

| A. | 表示1mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)的能量低于H2(g)和O2(g)的能量之和 | |
| D. | 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
9.下列叙述错误的是( )
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
8.某硫酸厂以硫铁矿为原料生产硫酸的过程如下:
(1)现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4108吨.(除上述硫的损失外,忽略其它损失)
(2)将含Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1的浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得溶液中c(Cu2+)=0.3mol•L-1.试计算:
①反应放出的气体在标准状况下的体积(不考虑气体的溶解)是4.48L.
②稀释后的溶液中含有的c(H+)是0.84mol/L.
0 169753 169761 169767 169771 169777 169779 169783 169789 169791 169797 169803 169807 169809 169813 169819 169821 169827 169831 169833 169837 169839 169843 169845 169847 169848 169849 169851 169852 169853 169855 169857 169861 169863 169867 169869 169873 169879 169881 169887 169891 169893 169897 169903 169909 169911 169917 169921 169923 169929 169933 169939 169947 203614
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
(2)将含Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1的浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得溶液中c(Cu2+)=0.3mol•L-1.试计算:
①反应放出的气体在标准状况下的体积(不考虑气体的溶解)是4.48L.
②稀释后的溶液中含有的c(H+)是0.84mol/L.
 (用电子式表示).
(用电子式表示).
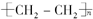 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;