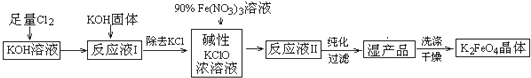
题目内容
16.海洋是资源的宝库,海水中几乎存在所有的天然元素.海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L).(1)海洋中含量最高的卤素元素在周期表中的位置为第三周期ⅤⅡA族;与其同周期相邻且单质为固体的元素原子的核外电子排布式为1s22s22p63s23p4.
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为S2->Cl->O2->Na+>Mg2+(用离子符号表示),其中形成的化合物中能发生潮解的是
 (用电子式表示).
(用电子式表示).(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向.请写出:
①铍铝硅酸盐的氧化物形式的化学式:3BeO•Al2O3•6SiO2.
②Be(OH)+与强碱溶液反应的离子方程式:Be(OH)++3OH-=BeO22-+2H2O.
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是b(选填编号).
a.海水提溴:海水浓缩$\stackrel{氯气}{→}$$→_{或水蒸气}^{热空气}$溴蒸气$\stackrel{SO_{2}吸收}{→}$$\stackrel{氧化}{→}$$\stackrel{蒸馏}{→}$液溴
b.海水提镁:海滩贝壳$\stackrel{煅烧}{→}$$\stackrel{水}{→}$石灰乳$\stackrel{海水}{→}$$\stackrel{过滤}{→}$$\stackrel{灼烧}{→}$MgO$→_{电解}^{熔化}$镁
c.海带提碘:海带灼烧$\stackrel{浸泡}{→}$$\stackrel{过滤}{→}$滤液$→_{萃取、分液}^{CCl_{4}、氯水}$含碘有机溶液$\stackrel{蒸馏}{→}$碘晶体
d.海盐提纯:海盐$\stackrel{溶解}{→}$$\stackrel{过滤}{→}$$\stackrel{蒸发}{→}$精盐$→_{沉淀}^{稍过量Na_{2}CO_{3}溶液}$$→_{沉淀}^{稍过量BaCl_{2}溶液}$$\stackrel{过滤}{→}$滤液$→_{调节pH}^{盐酸}$$\stackrel{蒸发}{→}$食盐晶体.
分析 (1)海洋中含量最高的卤素为氯元素;与氯同周期相邻且单质为固体的元素为硫元素;
(2)根据离子电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小;氯化镁易潮解;
(3)根据元素守恒和化合价代数各为零可写出氧化物形式的化学式;根据铝与氢氧化钠反应的原理书写Be(OH)+与强碱溶液反应的离子方程式;
(4)根据工业上从海水中提取溴、镁、碘、食盐的流程判断;
解答 解:(1)海洋中含量最高的卤素为氯元素,位于第三周期ⅤⅡA族,与氯同周期相邻且单质为固体的元素为硫元素,硫原子的核外电子排布式为1s22s22p63s23p4,
故答案为:第三周期ⅤⅡA族;1s22s22p63s23p4;
(2)根据离子电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,所以离子半径S2->Cl->O2->Na+>Mg2+,其中形成的化合物中能发生潮解的是氯化镁,它的电子式是 ,
,
故答案为:S2->Cl->O2->Na+>Mg2+; ;
;
(3)铍铝硅酸盐Be3Al2Si6O18的氧化物形式的化学式为3BeO•Al2O3•6SiO2,Be(OH)+与强碱溶液反应的离子方程式为Be(OH)++3OH-=BeO22-+2H2O,
故答案为:3BeO•Al2O3•6SiO2;Be(OH)++3OH-=BeO22-+2H2O;
(4)a.海水提溴:海水浓缩$\stackrel{氯气}{→}$$→_{或水蒸气}^{热空气}$溴蒸气$\stackrel{SO_{2}吸收}{→}$$\stackrel{氧化}{→}$液溴,故a正确;
b.海水提镁:海滩贝壳$\stackrel{煅烧}{→}$$\stackrel{水}{→}$石灰乳$\stackrel{海水}{→}$$\stackrel{过滤}{→}$加盐酸溶解,再在酸性环境中蒸发得氯化镁,再电解氯化镁得镁,故b错误;
c.海带提碘:海带灼烧$\stackrel{浸泡}{→}$$\stackrel{过滤}{→}$滤液$→_{萃取、分液}^{CCl_{4}、氯水}$含碘有机溶液$\stackrel{蒸馏}{→}$碘晶体,故c正确;
d.海盐提纯:海盐$\stackrel{溶解}{→}$$\stackrel{过滤}{→}$$\stackrel{蒸发}{→}$精盐$→_{沉淀}^{稍过量Na_{2}CO_{3}溶液}$$→_{沉淀}^{稍过量BaCl_{2}溶液}$$\stackrel{过滤}{→}$滤液$→_{调节pH}^{盐酸}$$\stackrel{蒸馏}{→}$$\stackrel{蒸发}{→}$食盐晶体,故d正确;
故选b.
点评 本题主要考查了海水的综合利用,涉及元素周期表、元素周期律、电子式、离子浓度比较、海水的中镁、溴、碘、食盐的提取,内容较多,综合性较强,中等难度.

 阅读快车系列答案
阅读快车系列答案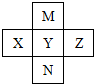
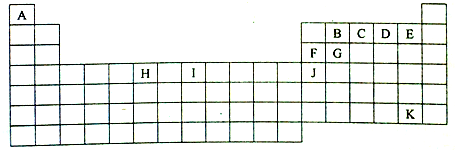
| A. | M形成的氢化物有2种 | |
| B. | M、Y、N的气态氢化物稳定性依次减弱 | |
| C. | X、Y、Z的含氧酸酸性依次增强 | |
| D. | Y的一种氧化物是大气污染物,是形成酸雨的主要物质 |
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
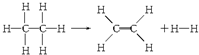
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
下列说法中不正确的是( )
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) | C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
PCl5(g)?PCl3(g)+Cl2(g)
经一段时间后反应达到平衡,反应过程中测得的部分数据见下表:
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(PCl5)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol•L-1,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0molPCl5和0.20 molCl2,在反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0molPCl5和1.0 molCl2,在反应达到平衡时PCl5的转化率为80% |
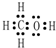 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.