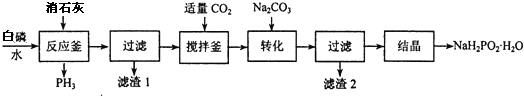
题目内容
13.已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据如图1转化关系回答问题.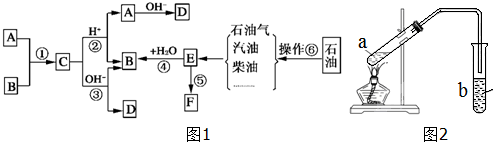
(1)分别写出A和E中官能团的名称:A中羧基;E中碳碳双键;
(2)操作⑥的名称为分馏.
(3)每步的反应类型分别为①酯化反应或取代反应④加成反应⑤加聚反应;
(4)请写出下列反应的化学方程式:
①写出反应①在浓硫酸溶液中加热反应的方程式CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
②B在金属铜存在下在空气中加热反应2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
③F在空气中完全燃烧
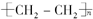 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.④D的钠盐与稀盐酸反应CH3COONa+HCl→CH3COOH+NaCl
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便.然而,这种材料造成的当今的某一环境问题是白色污染
(6)在实验室也可以用如图2所示的装置制取C,请回答下列问题
①试管a中加入几块碎瓷片的目的是防止暴沸.
②反应开始前,试管b中盛放的溶液是饱和碳酸钠溶液.作用是中和挥发出来的乙酸,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层
③可用分液的方法把制得的C分离出来.
分析 E是石油化工发展水平的标志,则E为CH2=CH2,A、B、F是家庭中常见的有机物,E通过加聚反应得到常见的高分子材料F,则F为聚乙烯;E与水发生加成反应生成B为C2H5OH,A与B反应生成C,C能在酸或碱条件下水解生成A、B、D,则A为CH3COOH,C为CH3COOCH2CH3,D为CH3COONa,由操作⑥可知,为石油分馏,在乙酸乙酯的制备中,试管a中加入几块碎瓷片可以防止暴沸,用饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层,再进行分液分离,如果导管伸入液面下,由于装置内压强降低,可能发生倒吸,为防止倒吸,导管不能伸入液面下,以此来解答.
解答 解:E是石油化工发展水平的标志,则E为CH2=CH2,A、B、F是家庭中常见的有机物,E通过加聚反应得到常见的高分子材料F,则F为聚乙烯;E与水发生加成反应生成B为C2H5OH,A与B反应生成C,C能在酸或碱条件下水解生成A、B、D,则A为CH3COOH,C为CH3COOCH2CH3,D为CH3COONa,
(1)A为乙酸,含有羧基,E为乙烯,含有官能团为:碳碳双键,故答案为:羧基;碳碳双键;
(2)因石油中各馏分的沸点不同,可利用分馏的方法来得到各馏分,所以操作⑥为分馏,故答案为:分馏;
(3)由上述分析可知,反应①是乙醇与乙酸发生酯化反应生成乙酸乙酯,也属于取代反应,反应④是乙烯与水发生加成反应生成乙醇,反应⑤是乙烯发生加聚反应生成聚乙烯,
故答案为:酯化反应或取代反应;加成反应;加聚反应;
(4)①反应①是乙醇与乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
②乙醇在金属铜存在下在空气中加热生成乙醛,化学反应方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
③F在空气中完全燃烧的方程式为: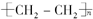 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O,
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O,
故答案为: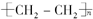 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O;
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O;
④D的钠盐与稀盐酸反应方程式为:CH3COONa+HCl→CH3COOH+NaCl,
故答案为:CH3COONa+HCl→CH3COOH+NaCl;
(5)F为聚乙烯,难以降解,容易产生白色污染,故答案为:白色污染;
(6)①试管a中加入几块碎瓷片可以防止暴沸,
故答案为:防止暴沸;
②在乙酸乙酯的制备中,用饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层,
故答案为:饱和碳酸钠溶液;中和挥发出来的乙酸,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层;
③乙酸乙酯与水溶液互不相溶,利用分液的方法进行分离,
故答案为:分液.
点评 本题考查有机物的推断,涉及烯烃、醇、羧酸、酯等性质与转化,E为乙烯是解答本题的突破口,再根据各物质之间的转化推出各物质,注意掌握乙酸乙酯的制备,有利于基础知识的巩固,难度不大.

| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
| A. | 水、双氧水、水玻璃都是纯净物 | B. | 乙醚和乙醇互为同分异构体 | ||
| C. | 乙醇、氯气、葡萄糖都是非电解质 | D. | 甲酸与硬脂酸属于同系物 |
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
(2)将含Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1的浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得溶液中c(Cu2+)=0.3mol•L-1.试计算:
①反应放出的气体在标准状况下的体积(不考虑气体的溶解)是4.48L.
②稀释后的溶液中含有的c(H+)是0.84mol/L.
| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解) | |
| B. | 1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子 | |
| C. | 在该溶液中,K+、NH4+、I-、SO42-可以大量共存 | |
| D. | 与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+ |
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |