题目内容
11.已知断裂1molC-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为: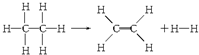
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
分析 △H=反应物键能和-生成物键能和,据此解答.
解答 解:1mol乙烷含有1molC-C键,6molC-H键,生成的乙烯含1molC=C键1molH-H键和4molC-H键,△H=347.4KJ+6×414.4KJ-4×414.4KJ-615.3KJ-435.3KJ=+125.6KJ,所以该反应吸收125.6KJ的热量,
故选:D.
点评 本题考查学生化学反应中的能量变化知识,注意根据反应热与键能的关系计算,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列措施能减慢H2O2分解速率,有利于双氧水长时间保存的是( )
| A. | 放在无色透明细口瓶中 | B. | 置于冷暗处 | ||
| C. | 置于通风透光处 | D. | 加入少量MnO2或FeCl3溶液 |
3.无机非金属材料的品种繁多,用途各异.下列物质中属于无机非金属材料的是( )
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
2.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
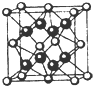 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +CaCl2+H2O
+CaCl2+H2O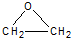
 (用电子式表示).
(用电子式表示). (1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
(1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下: