题目内容
9.下列叙述错误的是( )| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
分析 A、碱金属的最外层电子数等于主族序数;
B、Li、Na、K、Rb、Cs,单质熔沸点逐渐降低;
C、元素的非金属性越强,单质的氧化性越强;
D、元素的非金属性越强,氢化物越稳定.
解答 解:A、碱金属的最外层电子数=主族序数=1,故A正确;
B、按照Li、Na、K、Rb、Cs的顺序,单质熔沸点逐渐降低,密度增大,故B错误;
C、非金属性I<Br<Cl<F,则对应氧化性为由弱到强,所以单质氧化性:F2>Cl2>Br2>I2,故C正确;
D、元素的非金属性越强,氢化物越稳定,非金属性I<Br<Cl<F,所以氢化物稳定性:HF>HCl>HBr>HI,故D正确,
故选B;
点评 本题考查元素周期律的应用,为高频考点,把握元素的位置及元素周期律为解答的关键,注意非金属性比较方法及应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下表列出了①~⑩十种元素在周期表中的位置:
(1)上述①~⑩十种元素中(用元素符号填空):构成有机物的主要元素是C,构成岩石与许多矿物的基本元素是Si,化学性质最不活泼的元素是Ar,气态氢化物的水溶液呈碱性的元素是N.
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
20.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
17.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:14C | B. | HF的电子式: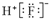 | ||
| C. | Cl-离子的结构示意图: | D. | 氧化铝的化学式:AlO |
4.m g Na在足量Cl2中燃烧,生成的固体质量为(m+3.55)g,则m g Na与O2反应,生成的固体质量可能为
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
14.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的阴离子的结构示意图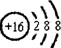 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
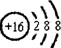 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
20.下列有关说法正确的是( )
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 | |
| D. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0 |
 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: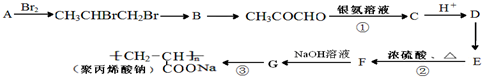
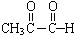 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$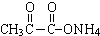 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.