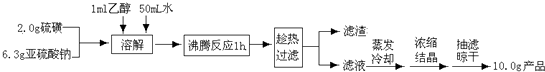
题目内容
15.测定Cu(NO3)2•nH2O的结晶水含量,下列方案中不可行的是( )| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| C. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO | |
| D. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
分析 测定Cu(NO3)2•nH2O里结晶水的含量,实验步骤为:①研磨,②称量空坩埚和装有试样的坩埚的质量,③加热,④冷却,⑤称量,⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止,⑦根据实验数据计算硝酸铜结晶水的含量,注意硝酸铜受热分解产物为氧化铜;注意硝酸铜容易分解,无法通过测定硝酸铜的质量测定含有结晶水数目,据此分析判断.
解答 解:Cu(NO3)2受热易分解,其分解反应为:2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑,
A.称量样品→加热→冷却→称量CuO,根据硝酸铜分解的方程式以及氧化铜的质量可测定Cu(NO3)2•nH2O的结晶水含量,故A错误;
B.因硝酸铜易分解,称量样品→加热无法恰好使结晶水合物恰好分解为硝酸铜,故B正确;
C.称量样品→加NaOH将硝酸铜转化为氢氧化铜,然后过滤→加热氢氧化铜分解生成氧化铜→冷却→称量CuO,根据铜原子守恒求解无水硝酸铜的质量,据此求解结晶水含量,故C错误;
D.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量,根据水的质量以及结晶水合物的质量可以求解,故D错误;
故选B.
点评 本题考查了通过晶体受热失水得到产物分析判断结晶水含量,题目难度中等,明确物质的性质及操作方法是解题关键,并注意某些物质的特殊性质,如硝酸铜容易分解,无法通过称量硝酸铜的质量测定结晶水含量.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
5.下列离子方程式中,正确的是( )
| A. | 将氨气通入醋酸中:NH3+H+═NH4+ | |
| B. | 在NH4Cl溶液中滴入氢氧化钠溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜屑放入稀硝酸中:Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
6.常温下,向10ml pH=10 的NaOH 溶液中逐滴加入 pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后溶液体积不变即溶液体积能简单相加),则对反应后溶液的叙述正确的是( )
| A. | c(A-)>c(Na+) | B. | c(H+)=c(OH-)<c(Na+)<c(A-) | ||
| C. | V(混)≥20mL | D. | V(混)≤20mL |
3.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 0.1 mol•L-1 CH3COOH溶液中含有的CH3COO-为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中含有的氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2,同时转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中含有的共用电子对的数目为6NA |
10.与图象有关的叙述,正确的是( )
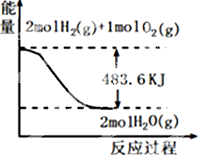

| A. | 表示1mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)的能量低于H2(g)和O2(g)的能量之和 | |
| D. | 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
7.化学与生活密切相关.据了解同学们的家中常备如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),利用上述用品你不能完成的任务是( )
| A. | 除去保温瓶中的水垢 | B. | 检验自来水中是否含有Cl- | ||
| C. | 检验买来的奶粉中是否加有淀粉 | D. | 洗去白色衣服上的番茄汁 |
4.在一密闭容器中,反应aA(g)═bB(g)达平衡(I).保持温度不变,将容器体积增加一倍,当达到新的平衡(II),实验测得cB(II):cB(I)B=2:5,则下列说法正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率降低 | ||
| C. | 物质B的质量分数增加 | D. | a<b |
6.下列根据实验操作、实验现象所得出的结论不正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 其他条件不变,压缩2HI(g)?I2(g)+H2(g)平衡体系的体积 | 混合气体颜色变深 | 平衡向生成I2(g)的方向移动 |
| C | 将碱式滴定管下部的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠 | 使溶液从尖嘴流出 | 排出碱式滴定管尖嘴部分的气泡 |
| D | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1-2滴0.01mol•L-1AgNO3溶液,振荡 | 沉淀呈黄色 | KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |