6.常温下经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
5.下列说法正确的是( )
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
1.某有机物结构简式如图所示,下列说法正确的是( )
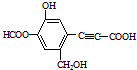

| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
0 169529 169537 169543 169547 169553 169555 169559 169565 169567 169573 169579 169583 169585 169589 169595 169597 169603 169607 169609 169613 169615 169619 169621 169623 169624 169625 169627 169628 169629 169631 169633 169637 169639 169643 169645 169649 169655 169657 169663 169667 169669 169673 169679 169685 169687 169693 169697 169699 169705 169709 169715 169723 203614
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
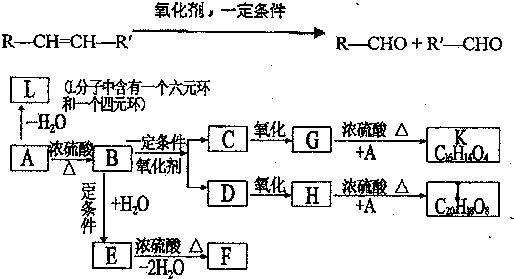
 、K
、K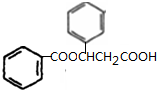 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$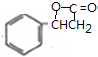 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应;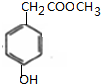 .
. A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+. 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: