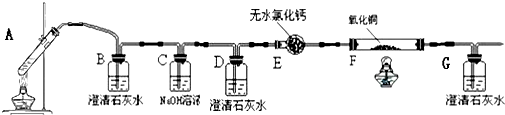
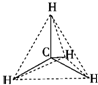
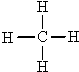
题目内容
6.常温下经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
分析 离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),CH3COONa为强碱弱酸盐,其溶液呈碱性,混合溶液呈酸性,则溶液中的溶质是CH3COONa和CH3COOH,且醋酸电离程度大于醋酸根离子水解程度,
A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.等物质的量的醋酸和NaOH恰好反应生成醋酸钠,醋酸钠溶液呈碱性;
C.反应后溶质为醋酸和醋酸钠,则醋酸溶液体积应该稍大;
D.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)中不满足电荷守恒.
解答 解:液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),溶液呈酸性,且溶液中存在c(CH3COO-)>c(Na+),如果溶质是醋酸钠,则溶液呈碱性,实际上溶液呈酸性,则溶液中的溶质为CH3COOH和CH3COONa,
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,溶液中醋酸电离程度大于醋酸根离子水解程度,则抑制水电离,则该溶液中由水电离的c(H+)<10-7mol/L,故A正确;
B.0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,二者恰好反应生成CH3COONa,醋酸钠为强碱弱酸盐,其溶液呈碱性,而不是酸性,故B错误;
C.该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,反应后溶质为CH3COOH和CH3COONa,则醋酸的体积应该大于氢氧化钠溶液体积,即:V1>V2,故C错误;
D.加入少量NaOH溶液,如果溶液中存在c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,根据溶液酸碱性结合溶质的性质确定溶液中的溶质,再结合电荷守恒来分析解答,离子浓度大小比较常常与弱电解质的电离、盐类水解联合考查,确定离子浓度大小常常根据原子守恒、物料守恒及质子守恒解答.

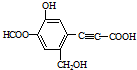
| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
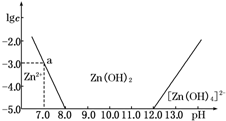 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
| A. | CH2═CH-CH═CH2 | B. | CH≡CH | C. | CH3C≡CH | D. | CH2═CH2 |
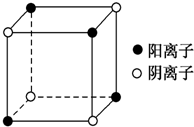 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题: