题目内容
1.某有机物结构简式如图所示,下列说法正确的是( )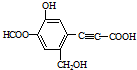
| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
分析 该分子中含有酯基、酚羟基、醇羟基、碳碳三键、羧基和苯环,具有酯、酚、醇、炔烃、羧酸和苯的性质,能发生水解反应、氧化反应、取代反应、显色反应、酯化反应、缩聚反应、加聚反应等,据此分析解答.
解答 解:A.该分子中分子式为C11H8O6,故A错误;
B.直接连接苯环的碳原子在同一平面上,碳碳单键可以旋转,所以分子中最多有11个碳原子共平面,故B错误;
C.该分子中含有醛基,所以能发生银镜反应,含有酚羟基和碳碳三键,能发生取代反应、还原反应,故C错误;
D.酚羟基、醇羟基、羧基能和钠反应,酚羟基和羧基及酯基水解生成的酚羟基和羧基能和氢氧化钠反应,只有羧基能和碳酸氢钠反应,1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酯、酚、醇、羧酸和不饱和烃的性质,易错选项是C,注意甲酸酯中含有醛基,为易错点.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
12.下列说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2,从而有效降低酸雨的产生和危害 | |
| B. | FeCl2、CuS、SO3、NO2都不能由单质间直接化合得到 | |
| C. | SO2既可以由硫的化合物氧化得到,又可以由硫的化合物还原得到 | |
| D. | 硫为不溶于水,易溶于酒精和CS2的黄色粉末 |
9.下列说法中正确的是( )
| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
16.类推的思维方法在化学学习与研究中常会产生错误的结论.因此类推出的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中正确的是( )
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 | |
| B. | NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色 | |
| D. | CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
6.常温下经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
10.甲、乙、丙、丁分别是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
 ;
;