题目内容
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
分析 A.依据体积和氢氧根离子浓度计算物质的量;
B.1个CH3+含有8个电子;
C.根据乙烯和丁烯的最简式都是CH2的特点来分析;
D.由乙烷分子中有六个碳氢键、一个碳碳键.
解答 解:A.溶液的pH=13,故C(H+)=10-13mol/L,可知C(OH-)=0.1mol/L,溶液体积为1.0L,故含有的氢氧根的物质的量为0.1mol,个数为0.1NA,故A错误;
B.1mol碳正离子CH3+所含的电子数=1mol×(6+3-1)NA=8NA ,故B错误;
C.乙烯和丁烯的最简式都是CH2,则乙烯的物质的量=$\frac{21g}{14g/mol}$,所以n(C)=1.5mol,N(C)=1.5NA,故C正确;
D.由乙烷分子中有六个碳氢键、一个碳碳键,则1mol乙烷分子含有7NA个共价键,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,熟悉相关公式的运用,有机物结构是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 | |
| B. | 元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类型的共价键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XnR | |
| D. | 元素W、R的最高价氧化物对应水化物都是强酸 |
11.下列的叙述中,不正确的是( )
| A. | 液氨汽化吸热,故液氨常做食品工厂的制冷剂 | |
| B. | 硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂和阻燃剂 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 可用冷的浓硝酸迅速除去铝壶底的水垢 |
5.下列说法正确的是( )
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
9.从能量的变化和反应的快慢等角度研究反应:2H2+O2═2H2O.
(1)已知该反应为放热反应,下图能正确表示该反应中能量变化的是A.
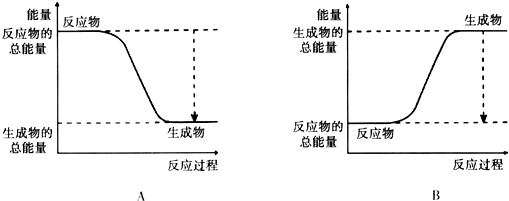
(2)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
由此计算2mol H2在氧气中燃烧生成气态水放出的热量484kJ
(3)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol
(4)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
(1)已知该反应为放热反应,下图能正确表示该反应中能量变化的是A.

(2)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(3)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol
(4)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯. ,F水溶液显性碱性(填:酸性、中性或碱性).
,F水溶液显性碱性(填:酸性、中性或碱性).