题目内容
3.瑞典皇家科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德•埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就.合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3.(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为1:1.
(2)当催化剂中Fe2+与Fe3+物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为0.724(用小数表示).
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:2Fe2O3+C═4FeO+CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为6 g.
分析 (1)设FeO、Fe2O3的物质的量分别为xmol、ymol,根据铁、氧的物质的量之比计算出FeO、Fe2O3的物质的量之比,进而确定Fe2+与Fe3+物质的量之比;
(2)设Fe2+与Fe3+物质的量分别为1mol、2mol,计算氧原子物质的量,再根据m=nM计算氧元素质量,进而计算氧化物中Fe元素质量分数;
(3)催化活性最高的催化剂,由(2)可知催化剂中Fe2+与Fe3+物质的量之比为1:2,根据n=$\frac{m}{M}$计算Fe2O3的物质的量,进而计算催化剂中FeO的物质的量,结合方程式计算需要碳粉的质量.
解答 解:(1)设FeO、Fe2O3的物质的量分别为xmol、ymol,则(x+2y)mol:(x+3y)mol=4:5,整理可得x:y=2:1,则Fe2+与Fe3+物质的量之比为x:2y=1:1,
故答案为:1:1;
(2)设Fe2+与Fe3+物质的量分别为1mol、2mol,则氧原子物质的量为1mol+3mol=4mol,故氧化物中Fe元素质量分数为$\frac{3mol×56g/mol}{3mol×56g/mol+4mol×16g/mol}$=0.724,故答案为:0.724;
(3)催化活性最高的催化剂,由(2)可知催化剂中Fe2+与Fe3+物质的量之比为1:2,Fe2O3的物质的量为$\frac{480g}{160g/mol}$=3mol,故催化剂中FeO的物质的量3mol×2×$\frac{1}{3}$=2mol,由方程式可知需要碳粉质量为2mol×$\frac{1}{4}$×12g/mol=6g,故答案为:6.
点评 本题考查混合物有关计算,涉及物质的量计算,侧重考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
14.SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于石蕊溶液,可观察到石蕊溶液( )
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
15.下列离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
1.下列反应属于加成反应的是( )
| A. | 甲烷与氯气反应 | B. | 乙烷的燃烧 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 乙烯使溴水褪色 |
 如图所示水槽中试管内有一枚铁钉,放置数天观察:
如图所示水槽中试管内有一枚铁钉,放置数天观察: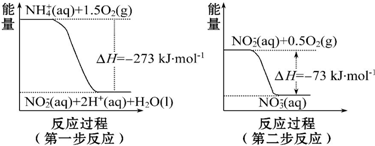
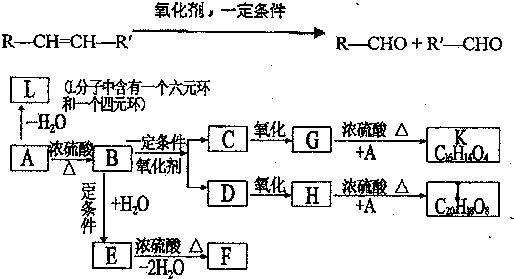
 、K
、K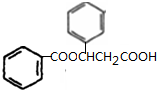 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$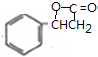 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应;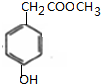 .
.