题目内容
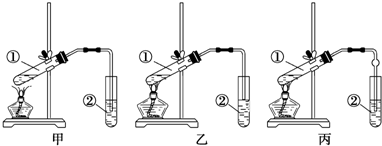
19. 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积.
(1)盐酸与镁反应的离子方程式为Mg+2H+=Mg2++H2↑.
(2)在上述实验方案中有一明显欠缺,该欠缺是没有说明两种酸的浓度相等.
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是盐酸的快,醋酸的慢;最终产生氢气的体积关系应是体积相等.
(4)实验中产生的氢气体积比理论值高,可能原因是反应放热,过量镁与水反应.
(5)通过比较起始反应的速率可以得出的结论是盐酸酸性比醋酸强.
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法测定同浓度的盐酸和醋酸的pH
测定醋酸钠和氯化钠溶液的pH.
实验二:某二元酸(H2B)在水中的电离方程式是:H2B=H++HB- HB-?H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?强电解质
(2)已知0.1mol•L-1NaHB溶液的pH=2,则0.1mol•L-1 H2B溶液中氢离子的物质的量浓度应<0.11mol•L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是CD.
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)═c(H+)+c(HB-)
C.c(Na+)+c(H+)═c(OH-)+c(HB-)+2c(B2-) D.c(Na+)═2c(B2-)+2c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
分析 实验一:(1)镁与盐酸反应生成氯化镁和氢气,据此写出反应的离子方程式;
(2)两种酸的浓度必须相等,才能比较反应速率快慢;
(3)醋酸为弱酸,溶液中只能部分电离出氢离子,则醋酸与镁的在开始时反应速率较小;由于两种酸的物质的量相等,则生成氢气的最终体积相等;
(4)该反应放热,过量镁与水反应生成了氢气;
(5)盐酸醋酸氢气速率快、醋酸慢,说明盐酸的酸性较强;
(6)比较酸的强弱,还可以测定相同浓度的醋酸和盐酸溶液的pH,或沉淀醋酸钠和氯化钠溶液的pH;
实验二:(1)在水溶液里或熔融状态下部分电离的电解质为弱电解质,完全电离的电解质为强电解质;
(2)根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步电离出的氢离子抑制第二步电离;
(3)根据二元酸的电离方程式知,B2-只发生第一步水解,根据溶液中的电荷守恒、物料守恒及质子守恒进行判断;
(4)根据离子是否电离确定钠离子和酸式酸根离子浓度大小,根据溶液的酸碱性确定氢离子和氢氧根离子浓度相对大小,根据离子来源确定氢离子和B离子相对大小.
解答 解:实验一:(1)镁与盐酸反应的离子方程式为:Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑;
(2)根据产生氢气的速率判断酸性强弱时,必须指出醋酸和盐酸的浓度相等,否则无法比较,
故答案为:没有说明两种酸的浓度相等;
(3)醋酸为弱酸,盐酸为强酸,浓度相等时醋酸中氢离子浓度小于盐酸,则与镁的反应中,盐酸的快,醋酸的慢;由于醋酸和盐酸的浓度、体积相等,镁过量,则最终生成氢气的体积相等,
故答案为:盐酸的快,醋酸的慢; 体积相等;
(4)镁在加热条件下能够与水反应,所以该反应放热,导致过量镁与水反应生成氢气,所以产生的氢气比理论值高,
故答案为:反应放热,过量镁与水反应;
(5)根据醋酸、盐酸与镁反应产生氢气的速率可知,盐酸中氢离子浓度大于醋酸,则盐酸的酸性大于醋酸,
故答案为:盐酸酸性比醋酸强;
(6)判断醋酸和盐酸的酸性强弱,还可以通过测定同浓度的盐酸和醋酸的pH或测定醋酸钠和氯化钠溶液的pH进行判断,
故答案为:测定同浓度的盐酸和醋酸的pH;测定醋酸钠和氯化钠溶液的pH;
实验二:(1)根据H2A=H++HA-知,H2A第一步完全电离,所以为强电解质,
故答案为:强电解质;
(2)根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步完全电离生成0.1mol/L的氢离子,第一步电离出的氢离子抑制第二步电离,所以第二步电离出的氢离子浓度小于0.01mol/L,则H2A溶液中氢离子的物质的量浓度应小于0.11mol/L,
故答案为:<;
(3)A.H2B第一步完全电离,所以溶液中不存在H2B,应该为c(B2-)+c(HB- )=0.1mol/L,故A错误;
B.H2B第一步完全电离,所以溶液中不存在H2B,溶液中存在质子守恒,根据质子守恒得:c(OH-)=c(H+)+c(HB-),故B错误;
C.根据电荷守恒得:c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故C正确;
D.根据物料守恒得:c(Na+)=2c(B2- )+2c(HB- ),故D正确;
故答案为:CD;
(4)钠离子不电离,HB-能电离,所以c(Na+)>c(HB-),根据(3)知,溶液呈酸性,则c(H+)>c(OH-),水和HB-都电离出氢离子,则c(H+)>c(B2-),所以该溶液中离子浓度大小顺序是c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),
故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
点评 本题考查了酸性强弱比较、离子浓度大小比较、溶解度在的电离平衡及其影响等知识,注意掌握判断酸性强弱的方法,明确弱电解质的电离平衡及其影响因素,能够根据电荷守恒、物料守恒、质子守恒及盐的水解原理判断各离子浓度大小.


| A. | 电池负极反应为:Zn-2e-═Zn2+ | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.