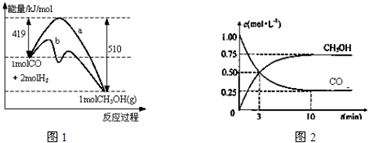
9.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-═Cl2↑+2e- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu═Cu2++2e- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
8.关于工业合成氨的叙述中错误的是( )
| A. | 在动力、设备、材料允许的条件下尽可能在高压下进行 | |
| B. | 温度越高越有利于工业合成氨 | |
| C. | 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 | |
| D. | 及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
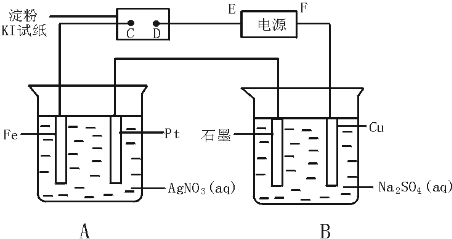
7.含下列溶质的稀溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH值增大的是( )
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
5.下列物质中不属于高分子化合物的是( )
| A. | 蛋白质 | B. | 油脂 | C. | 淀粉 | D. | 聚乙烯 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)═c(H+)+c(HS-)+c (H2S) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合:c(HCN)+c(CN-)═2 c(Na+) |
2.下列离子方程式书写正确的是( )
| A. | 工业上将硫酸工业尾气SO2持续通入氨水中:SO2+OH-═HSO3- | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应:2H2O-4e-═O2↑+4H+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
1.下列说法正确的是( )
0 169187 169195 169201 169205 169211 169213 169217 169223 169225 169231 169237 169241 169243 169247 169253 169255 169261 169265 169267 169271 169273 169277 169279 169281 169282 169283 169285 169286 169287 169289 169291 169295 169297 169301 169303 169307 169313 169315 169321 169325 169327 169331 169337 169343 169345 169351 169355 169357 169363 169367 169373 169381 203614
| A. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 石油裂解和油脂皂化都有高分子生成小分子的过程 |
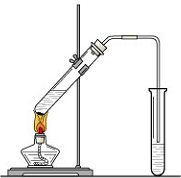 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题: