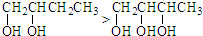题目内容
9.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-═Cl2↑+2e- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu═Cu2++2e- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
分析 A.用惰性电极电解饱和食盐水时,阳极上氯离子放电;
B.氢氧燃料电池中,负极上氢气失电子发生氧化反应、正极上氧气得电子发生还原反应;
C.粗铜精炼石,粗铜作阳极、纯铜作阴极,阳极连接原电池正极、阴极连接原电池负极;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应.
解答 解:A.用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,电极反应式为2Cl-═Cl2↑+2e-,故A正确;
B.氢氧燃料电池中,负极上氢气失电子发生氧化反应、正极上氧气得电子发生还原反应,如果电解质溶液呈碱性,则正极反应式为O2+2H2O+4e-═4OH-,故B错误;
C.粗铜精炼石,粗铜作阳极、纯铜作阴极,阳极连接原电池正极、阴极连接原电池负极,所以粗铜连接原电池正极,纯铜连接原电池负极,阴极电极反应式为Cu2++2e-=Cu,故C错误;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,负极反应式为Fe═Fe2++2e-,故D错误;
故选A.
点评 本题考查原电池和电解池原理,明确离子放电顺序及原电池正负极的判断是解本题关键,难点是电极反应式的书写,注意B中电极反应式的书写要结合电解质特点书写,电解质不同其电极反应式不同,为易错点.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
4.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 能将工业酒精兑水后饮用,因为其中含有甲醇,它具有醇香味 |
17.下列变化过程需要吸收能量的是( )
| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. | 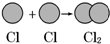 | D. | 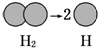 |
18.下列微粒结构示意图错误的是( )
| A. | 14C: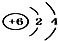 | B. | 16O: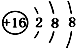 | C. | Li+: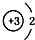 | D. | H-: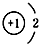 |
 .
. .
.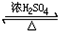 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.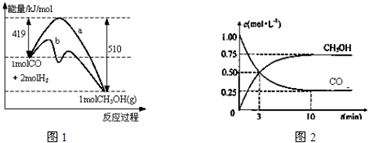
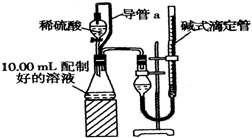 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液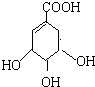 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: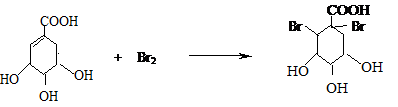 .
.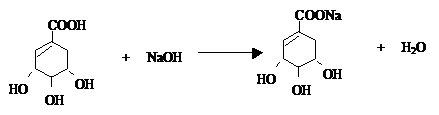 .
.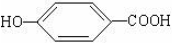 ),其反应类型消去反应.
),其反应类型消去反应.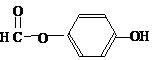 或
或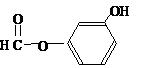 或
或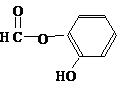 .
.