题目内容
6. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O;该反应属取代反应.
(2)该反应需加入一定量的浓硫酸,则浓硫酸的主要作用是催化作用,吸水作用.
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液(填操作名称);主要使用的玻璃仪器是分液漏斗.(答仪器的名称)
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化成生成物,反应一段时间后,达到了反应的限度,即达到化学平衡状态.下列描述能说明乙醇与乙酸的反应达到化学平衡状态的有(填序号)②④⑤.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应速率与逆反应速率相等
⑤反应混合物中各物质的浓度不再变化.
分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(3)导管伸入液面下可能发生倒吸;
(4)分离互不相溶的液体,可用分液的方法分离,依据操作步骤选择玻璃仪器;
(5)当可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率等于化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式为:CH3COOH+C2H5OH $?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,反应是酸脱羟基醇脱氢属于取代反应,
故答案为:CH3COOH+C2H5OH $?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,取代;
(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,故答案为:催化作用;吸水作用;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(4)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,分液的主要玻璃仪器为分液漏斗,
故答案为:分液,分液漏斗;
(5)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确,
故答案为:②④⑤.
点评 本题考查乙酸乙酯的制备、化学平衡状态的判断,是一道实验综合题,知识点较多,难度不大,注意掌握乙酸乙酯的制备方法及反应原理,明确化学平衡状态的判断方法,试题考查了学生分析问题的能力及化学实验能力.

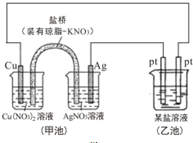
| A. | 实验过程中,甲池左侧烧杯中NO3-的浓度增大 | |
| B. | 图中甲池中的盐桥可以是装琼脂的饱和KCl溶液 | |
| C. | 若乙池为Na2SO4溶液,一段时间后,右边Pt极上产生了0.672L气体(标准状况),则甲池中Ag电极质量增加12.96g | |
| D. | Cu电极发生还原反应 |
| A. | CH2=CH-CH=CH2 | B. |  | C. | ClCH=CHCHO | D. | 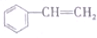 |
| A. | CO2的电子式: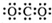 | B. | Cl-的结构示意图: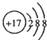 | ||
| C. | 乙醇的结构式:CH3CH2OH | D. | 乙烯的结构简式:CH2CH2 |
| A. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 石油裂解和油脂皂化都有高分子生成小分子的过程 |
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
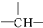 ,n个-C2H5,a个
,n个-C2H5,a个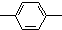 ,其余为氯原子,则氯原子的数目可能是( )
,其余为氯原子,则氯原子的数目可能是( )| A. | m+2-n | B. | n+2a-3m | C. | n+m+a | D. | a+n+2-2m |
 .
. .
.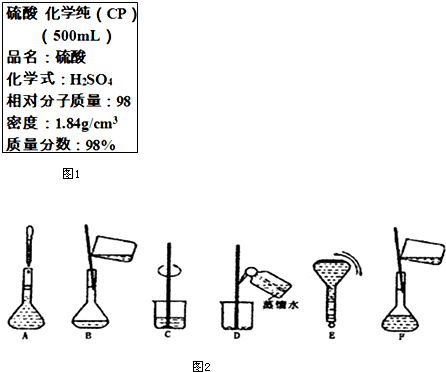 如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,