11.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
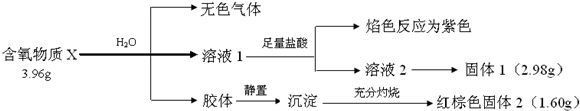
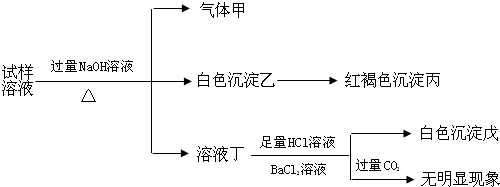
9.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
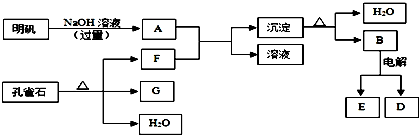
8.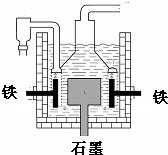 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
7.短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,D原子的核电荷数等于A、C原子核电荷数之和,A与C同主族.下列说法正确的是( )
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则由水电离出的OH-为10-12mol/L |
6.下列说法正确的是( )
| A. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| B. | 酸碱中和滴定常用的指示剂有酚酞、甲基橙和石蕊试液 | |
| C. | 除去Fe(OH)3胶体中的NaCl时,可将其装在用半透膜做的袋子里,放在流动的蒸馏水中,该分离方法称为渗析 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
5.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
3.(1)在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
①根据上述数据判断,该可逆反应的正反应是放热(填“吸热”或“放热”)反应,理由是温度升高,平衡常数减小.
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
2.下列说法不正确的是( )
0 169127 169135 169141 169145 169151 169153 169157 169163 169165 169171 169177 169181 169183 169187 169193 169195 169201 169205 169207 169211 169213 169217 169219 169221 169222 169223 169225 169226 169227 169229 169231 169235 169237 169241 169243 169247 169253 169255 169261 169265 169267 169271 169277 169283 169285 169291 169295 169297 169303 169307 169313 169321 203614
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |