题目内容
10.(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:(1)电解精炼粗铜时,粗铜与电源的正极(正极或负极)相连
(2)固体A用稀盐酸溶解的原因是抑制铁盐和铜盐水解反应;
(3)加何种试剂可以调节溶液的pH后得溶液B?AC
A.CuO B.Na2CO3 C.Cu2(OH)2CO3 D.稀氨水
(4)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(Ⅱ)某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.某研究小组设计并完成如下实验:
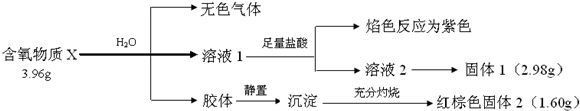
试回答如下问题:
(1)X的化学式为K2FeO4,写出X与H2O反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
(2)工业上由红棕色固体2可以制备其单质,写出化学方程式Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$3CO2+2Fe
(3)保存X时应注意避免吸潮和受热,写出X在实际生活中的一种应用可作净水剂.
分析 (Ⅰ)(1)电解过程中,粗铜作阳极,应该为电源的正极相连;
(2)铜离子和铁离子都能在水溶液中发生水解反应,避免水解,用稀盐酸溶解;
(3)调节溶液pH的目的是除去铁离子,所选试剂不能与铜离子反应,也不能引进杂质;
(4)铜离子变成了亚铜离子,被还原,亚硫酸根被氧化成硫酸根,写成反应,根据化合价升降相等配平方程式;
(Ⅱ)根据题中各物质转化关系,X与水反应生成溶液Ⅰ焰色反应为紫色,则X中含钾元素,溶液2应为氯化钾溶液,X与水反应生成胶体,沉淀后灼烧得红棕色固体2,则红棕色固体2为氧化铁,胶体为氢氧化铁,所以X中含有铁元素,某含氧物质X仅含三种元素,所以X由Fe、K、O组成,由于固体1为氯化钾,质量为2.98g,则其中钾元素的物质的量为0.04mol,固体2为氧化铁,质量为1.60g,则铁元素的物质的量为0.02mol,所以X中氧元素的物质的量为:$\frac{3.96-0.04×39-0.02×56}{16}$mol=0.08mol,所以X中Fe、K、O的物质的量之比为0.02:0.04:0.08=1:2:4,所以X的化学式为K2FeO4,根据氧化还原反应中电子得失守恒可知,X与水反应生成的无色气体为氧气,据此进行答题.
解答 解:(Ⅰ)(1)电解时,纯铜做阴极、粗铜做阳极,则粗铜应该与电源的正极相连,
故答案为:正极;
(2)为了防止铜离子、铁离子水解,一般用稀盐酸溶解氯化铁和氯化铜,
故答案为:抑制铁盐和铜盐水解反应;
(3)调节溶液pH后可以除去杂质铁离子,选用的试剂不能引进杂质,也不能与铜离子反应,可以选用A.CuO、C.Cu2(OH)2CO3,不能选用B.Na2CO3、D.稀氨水,
故答案为:AC;
(4)在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热生成了CuCl,亚硫酸根检验还原性,被氧化成硫酸根,根据化合价变化配平方程式可得:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(Ⅱ)根据题中各物质转化关系,X与水反应生成溶液Ⅰ焰色反应为紫色,则X中含钾元素,溶液2应为氯化钾溶液,X与水反应生成胶体,沉淀后灼烧得红棕色固体2,则红棕色固体2为氧化铁,胶体为氢氧化铁,所以X中含有铁元素,某含氧物质X仅含三种元素,所以X由Fe、K、O组成,由于固体1为氯化钾,质量为2.98g,则其中钾元素的物质的量为0.04mol,固体2为氧化铁,质量为1.60g,则铁元素的物质的量为0.02mol,所以X中氧元素的物质的量为$\frac{3.96-0.04×39-0.02×56}{16}$mol=0.08mol,所以X中Fe、K、O的物质的量之比为0.02:0.04:0.08=1:2:4,所以X的化学式为K2FeO4,根据氧化还原反应中电子得失守恒可知,X与水反应生成的无色气体为氧气,
(1)根据上面的分析可知,X的化学式为K2FeO4,X与H2O反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:K2FeO4;4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-;
(2)工业上由氧化铁制备铁的化学方程式为:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$3CO2+2Fe,
故答案为:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$3CO2+2Fe;
(3)由于K2FeO4与水会反应,所以保存K2FeO4时应注意避免吸潮和受热,K2FeO4在实际生活中由于与水反应可以生成氢氧化铁胶体,所以可作净水剂,
故答案为:避免吸潮和受热;可作净水剂.
点评 本题考查了常见金属单质及其化合物的综合应用,题目难度中等,涉及无机推断、物质的分离与提纯方法的综合应用、化学方程式的书写等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

| A. | 溶液中溶有NaOH | B. | 溶质可能是Cu2(OH)2CO3 | ||
| C. | 溶液中一定不含有H+离子 | D. | 溶液呈碱性 |
| A. | 活性炭、C60、金刚砂都是碳的同素异形体 | |
| B. | Fe2O3、Na2O2、K2O都是碱性氧化物 | |
| C. | 淀粉、蛋白质、油脂都属于有机高分子化合物 | |
| D. | 纯碱、氯化铵、明矾都是盐且都属于强电解质 |
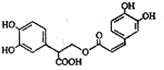
| A. | 迷迭香酸的分子式为C18H15O8 | |
| B. | 迷迭香酸可以发生加成、取代、显色反应 | |
| C. | lmol迷迭香酸跟H2反应,最多消耗6mol H2 | |
| D. | lmol迷迭香酸在NaOH溶液中反应,最多消耗5mol NaOH |
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
| A. | 右列图标均与燃烧和爆炸有关 | |
| B. | 棉、麻、蚕丝、羊毛及合成纤维都属于纤维,但均不含纤维素 | |
| C. | 科学家用单个分子制成了“纳米车”,它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞.“纳米车”说明在一定条件下,分子的热运动须在人工操纵下才能进行 | |
| D. | 捕获工业排放的CO2,既能降低地球的温室效应又能用来合成聚碳酸酯可降解塑料,实现碳的循环利用 |

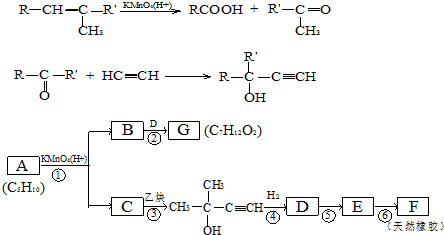
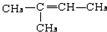 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2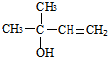 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$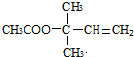 +H2O;
+H2O; .
.