题目内容
11.在下列给定条件的溶液中,一定能大量共存的离子组是( )| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
分析 A.无色溶液不含有色离子,且离子之间不反应的能共存;
B.含有大量Fe3+的溶液中不能大量存在和铁离子反应的离子;
C.pH=12的溶液呈碱性;
D.水电离产生的c(OH-)=1×10-14mol•L-1的溶液呈酸性或碱性.
解答 解:A.无色溶液不含有色离子,Fe2+呈浅绿色,不符合无色条件,故A错误;
B.Fe3+和SCN-发生络合反应而不能大量共存,故B错误;
C.pH=12的溶液呈碱性,铵根离子不能大量共存,故C错误;
D.水电离产生的c(OH-)=1×10-14mol•L-1的溶液呈酸性或碱性,这几种离子之间不反应,且和氢离子或氢氧根离子不反应,所以能大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,明确离子共存条件及离子性质是解本题关键,注意结合限制性条件分析解答,易错选项是B.

练习册系列答案
相关题目
2.化学与生产、生活息息相关,下列说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
6.下列说法正确的是( )
| A. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| B. | 酸碱中和滴定常用的指示剂有酚酞、甲基橙和石蕊试液 | |
| C. | 除去Fe(OH)3胶体中的NaCl时,可将其装在用半透膜做的袋子里,放在流动的蒸馏水中,该分离方法称为渗析 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
16.(1)将0.0lmol下列物质①Na2O2 ②Na2O ③Na2CO3 ④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是①=②>③>④(溶液体积变化忽略不计);
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1条件下平衡常数K=2.67(取小数二位,下同).
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
3.下列关于化学用语的表示正确的是( )
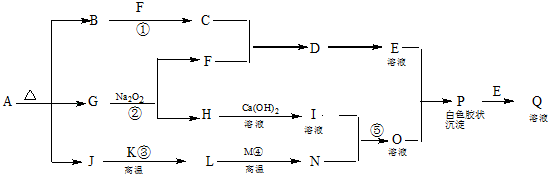
| A. | CO2的电子式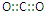 | |
| B. | CCl4的比例模型: | |
| C. | 含有18个中子的氯原子的核素符号:${\;}_{17}^{35}$Cl | |
| D. | 硫原子的结构示意图: |
20.已知在比较酸的强弱时,必须考虑两方面:一是酸电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确是( )
| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
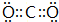 ;
;