1. (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)
据此作出的下列判断中,错误的是AB
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图( )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
Si(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$ SiO2(s),该反应的反应热△H=-990 kJ/mol
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为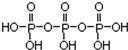 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
17.判断下列化合物的化学键的类型,并根据化学键类型归类化合物类型;
| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
16.根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
15.下列判断中一定正确的是( )
| A. | 若R2+和M+的电子层结构相同,则碱性:ROH>MOH | |
| B. | 若X2、Y2都是气态单质,且酸性HX>HY,则非金属性X>Y | |
| C. | 若A2+2D-=2A-+D2,则还原性:D->A- | |
| D. | 若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
14.下列物质加入水中,显著放热的是( )
| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |
13.下列对碱金属性质的叙述中正确的是( )
| A. | 都是银白色的柔软金属(除铯外),密度都小于水 | |
| B. | 单质的熔、沸点随原子序数的增加而升高 | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 氧化能力最强的是铯原子 |
12.下列物质中碱性最强的是( )
0 168835 168843 168849 168853 168859 168861 168865 168871 168873 168879 168885 168889 168891 168895 168901 168903 168909 168913 168915 168919 168921 168925 168927 168929 168930 168931 168933 168934 168935 168937 168939 168943 168945 168949 168951 168955 168961 168963 168969 168973 168975 168979 168985 168991 168993 168999 169003 169005 169011 169015 169021 169029 203614
| A. | LiOH | B. | NaOH | C. | Mg(OH)2 | D. | Al(OH)3 |
 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题: