题目内容
14.下列物质加入水中,显著放热的是( )| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |
分析 解此题的关键是看清放热两字,注意此题所研究的不一定是放热的化学反应,放热过程也可.如NaOH、CaO、浓H2SO4溶于水都是典型的放热过程;NH4NO3溶于水是吸热的;C2H5OH、NaCl等溶于水热效应不明显.
解答 解:A.生石灰溶于水会放出大量的热,故A正确;
B.固体氢氧化钠溶于水会放出大量的热,故B正确;
C.C2H5OH溶于水热效应不明显,故C错误;
D.NH4NO3溶于水是吸热的,故D错误.
故选AB.
点评 本题考查物质溶解于水中的热效应,难度不大,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
11.从碘的有机溶液中回收有机溶剂,可选用的实验装置是( )
| A. | 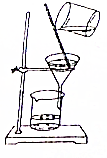 | B. | 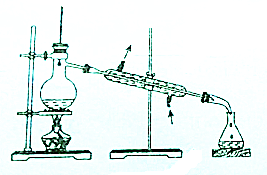 | ||
| C. | 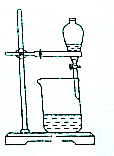 | D. | 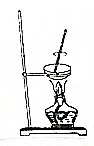 |
9.有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:7030Zn+20882Pb═277112Cn+10n.下列叙述中正确的是( )
| A. | 277112Cn的原子核内中子数比质子数多53 | |
| B. | Cn元素的相对原子质量为277 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
3.人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图.下列说法不正确的是( )


| A. | B是电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将增大 | |
| C. | 阳极室中发生的电极反应为:2Cl--2e-=Cl2↑ | |
| D. | 阳极室中发生的反应为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题: