题目内容
16.根据碘与氢气反应的热化学方程式(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
分析 已知:(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1,根据二者转化的热化学方程式判断.
解答 解:已知:(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1,
A.n(I2)=$\frac{254g}{254g/mol}$=1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B.由I2(g)=I2(s)△H=-35.96kJ•mol-1,可知I2(g)能量大于I2(s),所以反应(ii)的反应物总能量比反应(i)的反应物总能量低,故B正确;
C.反应(i)(ii)的产物都是HI,状态相同,稳定性相同,故C错误;
D.由I2(g)=I2(s)△H=-35.96kJ•mol-1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故D错误.
故选B.
点评 本题考查化学反应与能量,明确盖斯定律的应用是解答该题的关键,注意物质的稳定性与能量高低的关系,易错点为A,注意反应为可逆反应的特征.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.短周期元素X,Y,Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Y元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
4.下列说法不正确的是( )
| A. | 原子半径Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性强弱:H2SiO3<H2CO3<H3PO4 |
11.下列化学用语表示正确的是( )
| A. | Cl-的结构示意图: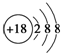 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧化钠的电子式: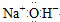 | D. | 铁元素不属于主族元素 |
1. (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)
据此作出的下列判断中,错误的是AB
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(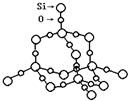 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
Si(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$ SiO2(s),该反应的反应热△H=-990 kJ/mol
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图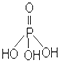 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为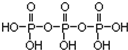 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
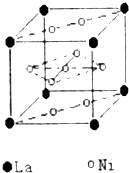
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
8.已知A、B、C是短周期的三种元素,原子序数依次递增,A、C同主族;A、B形成的化合物中,A的质量分数为40%;A、C形成的化合物中A的质量分数为50%或60%,以下说法不正确的是( )
| A. | 最高正价B<A=C | |
| B. | A、B形成的化合物中只含有离子键,A、C形成的化合物中只含有共价键 | |
| C. | A、B、C三种元素能组成两种不同的化合物 | |
| D. | A、C形成的一种化合物既有氧化性又有还原性 |
5.下列说法正确的是( )
| A. | 能使澄清石灰水变浑浊的气体一定是CO2 | |
| B. | 能使品红溶液褪色,将其煮沸又变红的无色气体为SO2 | |
| C. | 与浓H2SO4反应可产生SO2的一定是亚硫酸的正盐 | |
| D. | 某酸性溶液经分析含大量S2-,SO42-,MnO4- |
6.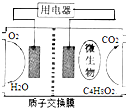 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 放电过程中,H+从左侧区向右侧区迁 | |
| C. | 负极反应为:C4H8O2+6H2O-20e-═4CO2↑+20H+ | |
| D. | 电池工作时右侧区域的pH将升高 |