题目内容
19. X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X、E的元素符号依次为S、F;
(2)XZ2与YZ2分子在相同条件下两者在水中的溶解度较大的是SO2(写分子式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(3)Q属于第四周期,它的核外电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6;
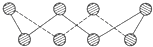
(4)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是sp3;
(5)H2Se的酸性比H2S强(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形,SO32-离子的立体构型为三角锥形.
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量(质量分数)最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,其核电荷数为24,故Q为Cr元素;E在元素周期表的各元素中电负性最大,则E为F元素,据此答题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量(质量分数)最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,其核电荷数为24,故Q为Cr元素;E在元素周期表的各元素中电负性最大,则E为F元素.
(1)由以上分析可知,X为S元素,E为F元素,故答案为:S;F;
(2)因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大,
故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,最高化合价为+6价,
故答案为:四;1s22s22p63s23p63d54s1;+6;
(4)S单质的常见形式为S8,S原子形成2个δ键,有2个孤电子对,杂化轨道数目为4,S原子采用的轨道杂化方式是sp3,
故答案为:sp3;
(5)键长H-Se>H-S,故H-S键比H-Se稳定,则H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对数为3+$\frac{6-2×3}{2}$=3,没有孤对电子,故其立体构型为:平面三角形,SO32-离子中S原子价层电子对数为3+$\frac{6+2-2×3}{2}$=4,含有1对孤对电子,故其立体构型为:三角锥形,
故答案为:强;平面三角形;三角锥形.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、杂化方式、空间构型判断等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.

| A. | H2O2的电子式 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |
| A. | 4种 | B. | 8种 | C. | 7种 | D. | 6种 |
| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |

| A. | “辛烷值”可用来表示汽油的质量,异辛烷的爆震程度最小.图1是异辛烷的球棍模型,系统命名为2,4,4三甲基戊烷 | |
| B. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| C. | 乙酸乙酯中除去乙酸:用饱和碳酸钠溶液洗涤后分液 | |
| D. | 图2化合物核磁共振氢谱图中有5个吸收峰 |
| A. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| C. | 0.1 mol•L-1稀硫酸中硫酸根离子个数为0.1 NA | |
| D. | 22gCO2与11.2LHCl含有相同的分子数 |
| A. | NaCl | B. | Cl2 | C. | HCl | D. | NaOH |
