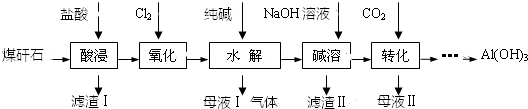
题目内容
13.下列对碱金属性质的叙述中正确的是( )| A. | 都是银白色的柔软金属(除铯外),密度都小于水 | |
| B. | 单质的熔、沸点随原子序数的增加而升高 | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 氧化能力最强的是铯原子 |
分析 A、铯是金黄色金属,Rb和铯密度大于水;
B、金属熔沸点从上到下熔沸点依次降低;
C、从上往下原子半径增大;
D、金属性越强对应单质的氧化性越弱.
解答 解:A、铯是金黄色金属,其他碱金属都是银白色的柔软金属,Rb和铯密度大于水,故A错误;
B、碱金属熔沸点从上到下熔沸点依次降低,故B错误;
C、从上往下原子半径增大,所以随核电荷数的增大而原子半径增大,故C正确;
D、从上往下金属性增强,根据金属性越强对应单质的氧化性越弱,所以还原性最强的是铯原子,故D错误;
故选:C.
点评 本题考查了碱金属的性质,注意抓住碱金属性质递变规律分析判断,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
10.短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的3倍,回答下列问题:
(1)甲在元素周期表中的位置第三周期ⅣA族;
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
| 乙 | 丙 | 丁 | |
| 甲 | 戊 |
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
1.2012年4月22日是第43个“世界地球日”,其主题为“绿色梦 想,低碳行动”.下列做法符合这一主题的是( )
①开发太阳能、风能和氢能等能源
②大量开采地下水,以满足生产、生活的需求
③使用布袋购物、以步代车等属于“低碳生活”方式
④开发利用可燃冰是缓解能源紧缺的唯一途径
⑤利用可降解的“玉米塑料”生产一次性饭盒.
①开发太阳能、风能和氢能等能源
②大量开采地下水,以满足生产、生活的需求
③使用布袋购物、以步代车等属于“低碳生活”方式
④开发利用可燃冰是缓解能源紧缺的唯一途径
⑤利用可降解的“玉米塑料”生产一次性饭盒.
| A. | ①③⑤ | B. | ①②③ | C. | ②④⑤ | D. | ①②④ |
5.巴豆酸的结构简式为CH3CH=CH-COOH,现有①氯化氢、②溴水、③纯碱溶液、④酸性高锰酸钾溶液、⑤2-丁醇. 试根据其结构特点判断在一定条件下能与巴豆酸反应的物质的组合是( )
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
2.氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体.以下有关推断中不正确的是( )
| A. | “另一种反应物”在反应中表现还原性 | |
| B. | CuH在化学反应中既可做氧化剂也可做还原剂 | |
| C. | CuH在氯气中燃烧的化学方程式为CuH+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl+HCl | |
| D. | CuH与盐酸反应生成的气体是H2 |
3.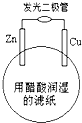 某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
 某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )| A. | 铜片上的电极反应:Cu2++2e-=Cu | |
| B. | 外电路中电子由铜片经导线流向锌片 | |
| C. | 电池工作时电能直接转化为化学能 | |
| D. | 该电池工作时,若有13克锌被溶解,则铜片上产生标况下4.48 LH2 |