题目内容
1. (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为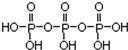 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
分析 (1)由表中熔点可知,SiO2、Al2O3属于原子晶体,NaCl、Na2O、AlF3属于离子晶体,AlCl3、BCl3和CO2的熔点都在200℃以下,都属于分子晶体;
(2)二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键;反应热△H=反应物总键能-生成物总键能;
(3)①三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,即磷酸分子间两个羟基脱去2分子水;三聚磷酸钠可以看作三聚磷酸中五个羟基的氢原子换成钠原子;
②由化合价代数为零可求算化合物中P元素的化合价;
(a)镍元素的化合价降低了2价,磷元素的化合价升高的2价,化合价升降最小公倍数为2,故Ni2+、H2PO2-的系数均为1,H2PO3-+的系数为1,根据电荷守恒可知生成物中缺项为H+,再根据原子守恒、电荷守恒配平;
(4)利用均摊法计算晶胞中原子数目,进而确定化学式.
解答 解:(1)A.由表中数据可知,AlF3为离子晶体,故A错误;
B.表中AlCl3、BCl3和干冰是分子晶体,沸点都较低,故B错误;
C.C和Si同主族,但氧化物的晶体类型不同,分别属于分子晶体和原子晶体,故C正确;
D.Na和Si不同主族,氧化钠属于离子晶体,二氧化硅属于原子晶体,不同族元素的氧化物可形成不同类型的晶体,故D正确.
故答案为:AB;
(2)二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,则SiO2晶体中Si和Si-O键的比例为1:4,
因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,每Si原子与周围的4个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子提供1212个Si-Si键,所以1mol晶体硅中含有1mol×4×1212=2molSi-Si键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol,
故答案为:1:4;-990 kJ/mol;
(3)①三分子磷酸间通过羟基脱水脱去2分子水形成三聚磷酸,所以三聚磷酸的结构式为: ;三聚磷酸中羟基的氢原子被钠原子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,
;三聚磷酸中羟基的氢原子被钠原子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,
故答案为: ; Na5P3O10;
; Na5P3O10;
②根据化合价代数和为0,NaH2PO2中P元素的化合价为+1,
(a)镍元素的化合价降低了2价,磷元素的化合价升高的2价,故Ni2+、H2PO2-的系数均为1,H2PO3-+的系数为1,根据电荷守恒可知生成物中缺项为H+,根据原子守恒、电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,
故答案为:+1;1、1、1H2O、1、1、2H+;
(4)该合金的晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×1212=5,晶胞实际含有的镧原子为8×1818=1,所以晶体的化学式Ni5La,
故答案为:Ni5La.
点评 本题考查晶体类型与熔沸点关系、反应热有关计算、晶胞结构及计算、氧化还原反应配平等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

| A. | Fe3+、Mg2+、I-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | H+、Na+、Ca2+、ClO- | D. | Ba2+、K+、OH-、CO32- |
| A. | 277112Cn的原子核内中子数比质子数多53 | |
| B. | Cn元素的相对原子质量为277 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| A. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
| A. | 氯化钙的电子式: | |
| B. | 168O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )