题目内容
17.判断下列化合物的化学键的类型,并根据化学键类型归类化合物类型;| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
分析 活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物属于离子化合物,只含共价键的化合物属于共价化合物,据此分析.
解答 解:HCl是氢原子与氯原子之间以共价键形成的共价化合物;NaCl是钠离子与氯离子之间的离子键形成的离子化合物;NaOH是钠离子与氢氧根离子之间的离子键和氧原子与氢原子之间的共价键的离子化合物;NH4Cl是铵根离子与氯离子之间的离子键,氮与氢之间的共价键的离子化合物;
所以
| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
点评 本题考查了化学键与化合物的判断,注意共价化合物中只含共价键,离子化合物中肯定含有离子键,可能含有共价键.

练习册系列答案
相关题目
14.在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有Ag+和SO42- | D. | 可能含有Ag+或SO42- |
12.下列物质中碱性最强的是( )
| A. | LiOH | B. | NaOH | C. | Mg(OH)2 | D. | Al(OH)3 |
9.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成SO3为2 mol | |
| B. | 反应放出197 kJ 的热量 | |
| C. | SO2和SO3物质的量之和一定为2mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
6.以下实验能获得成功的是( )
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将电石与水直接混合可以平稳快速制备乙炔 | |
| D. | CCl4加入盛碘水的分液漏斗中振荡、静置,从下口放出紫红色溶液 |
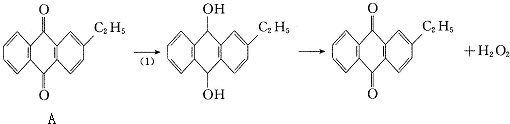
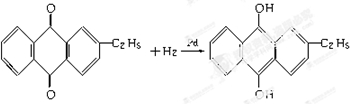 .
.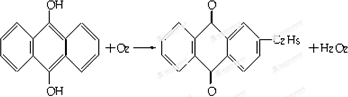 .
.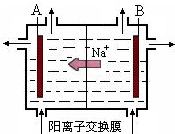 西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题:
西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题: