8.家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到.电解总反应式为:C21H41COOH+X+4NaOH→C23H46+2Na2CO3+2H2O+H2↑
芥酸 雌性信息素
则下列说法不正确的是( )
芥酸 雌性信息素
则下列说法不正确的是( )
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
7.某铁矿石样品除含SiO2外,主要成分是铁的氧化物.某化学兴趣小组对铁矿石进行探究.
(1)探究铁矿石中铁的价态.
①某同学将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现血红色.由此得出该铁矿石中铁元素价态为+3的结论.你认为此结论不合理(填“合理”或“不合理”),其理由稀硝酸具有强氧化性,能将样品中的+2价的铁元素氧化为+3价.
②请完成下表对铁元素价态的探究实验:
限选试剂:3mol•L-1H2SO4溶液、3% H2O2溶液、6mol•L-1HNO3溶液、0.01mol•L-1KMnO4溶液、稀NaOH溶液、0.1mol•L-1KI溶液、20%KSCN溶液、蒸馏水.
(2)探究铁矿石中铁的含量.
将2.25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL,利用反应5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O 对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液进行滴定,平均消耗0.02mol•L-1KMnO4溶液的体积为25.00mL,求铁矿石中铁元素的质量分数(写出计算过程,并保留3位有效数字)
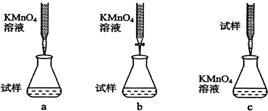
②下列滴定方式中,最合理的是(夹持部分略去)b.
③在滴定过程中,不需要(填“需要”或“不需要”)指示剂来确定滴定终点.
(1)探究铁矿石中铁的价态.
①某同学将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现血红色.由此得出该铁矿石中铁元素价态为+3的结论.你认为此结论不合理(填“合理”或“不合理”),其理由稀硝酸具有强氧化性,能将样品中的+2价的铁元素氧化为+3价.
②请完成下表对铁元素价态的探究实验:
限选试剂:3mol•L-1H2SO4溶液、3% H2O2溶液、6mol•L-1HNO3溶液、0.01mol•L-1KMnO4溶液、稀NaOH溶液、0.1mol•L-1KI溶液、20%KSCN溶液、蒸馏水.
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |
将2.25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL,利用反应5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O 对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液进行滴定,平均消耗0.02mol•L-1KMnO4溶液的体积为25.00mL,求铁矿石中铁元素的质量分数(写出计算过程,并保留3位有效数字)
②下列滴定方式中,最合理的是(夹持部分略去)b.

③在滴定过程中,不需要(填“需要”或“不需要”)指示剂来确定滴定终点.
5.在2L恒容密闭容器中充入3mol CO气体、3mol H2,发生反应:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g).CO的平衡转化率(α)与温度、压强的关系如图所示:( )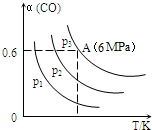

| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
3.某X溶液可使甲基橙呈红色,在该溶液中可能含有K+、Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、AlO2-、SiO32-、C1-中的若干种,现取X溶液进行连续实验,实验过程现象及产物如下,下列说法正确的是( )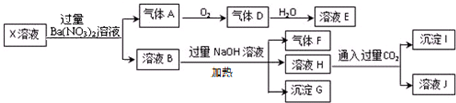

| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
2.下列说法正确的是( )
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |
1.“三酸二碱”在化工生产中有着重要的应用.下列说法正确的是( )
0 168670 168678 168684 168688 168694 168696 168700 168706 168708 168714 168720 168724 168726 168730 168736 168738 168744 168748 168750 168754 168756 168760 168762 168764 168765 168766 168768 168769 168770 168772 168774 168778 168780 168784 168786 168790 168796 168798 168804 168808 168810 168814 168820 168826 168828 168834 168838 168840 168846 168850 168856 168864 203614
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 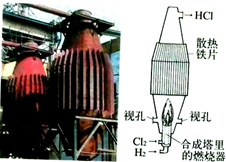 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.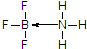 .
. 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: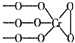 ,则Cr的化合价为+5.
,则Cr的化合价为+5.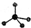 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为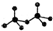 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.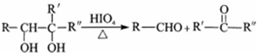
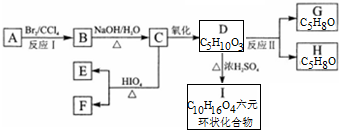
 +2H2O.
+2H2O.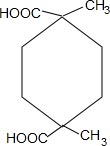 .
.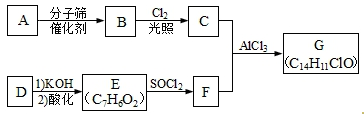
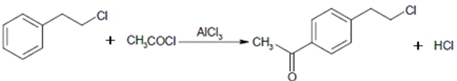
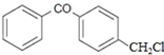 .
.
 .
.