题目内容
6. 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为
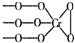 ,则Cr的化合价为+5.
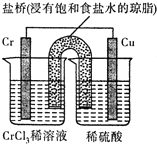
,则Cr的化合价为+5.(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+),而后又变成绿色 (Cr3+).该电池总反应的过程表示为:Cr+2H+=Cr2++H2↑,2Cr2++2H+=2Cr3++H2.左侧烧杯溶液中c(Cl-)增大(填“增大”,“减小”或“不变”).
(3)已知Ksp(BaCrO4)=1.2×10-10,Ksp(PbCrO4)=2.8×10-13,Ksp(Ag2CrO4)=2,.0×10-12.某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01mol/L,向该溶液中逐滴入 0.01mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为Pb2+、Ba2+、Ag+.
(4)在溶液中存在如下平衡:
CrO42-+H+?HCrO4- K1=105.9;
Cr2O72-+H2O?2HCrO4- K=10-2.2
则反应:2CrO42-+H+?Cr2O72-+H2O的平衡常数K=1014.
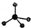
(5)CrO42-呈四面体构型,结构为
 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为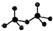 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.(6)CrO3是H2CrO4的酸醉,受热易分解.把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%.写出 CrO3受热分解化学方程式:4CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑.
分析 (1)根据化合物化合价代数和为0结合阴离子结构为 解答;
解答;
(2)根据观察到Cu电极上产生大量的无色气泡则有氢气生成,Cr电极周围出现天蓝色(Cr2+),而后又变成绿色 (Cr3+),说明铬先失电子生成二价铬,后又失电子生成三价铬;根据阴离子移向阴极判断左侧烧杯溶液中c(Cl-);
(3)析出沉淀时,BaCrO4溶液中c(CrO42-)=$\frac{Ksp(BaCrO{\;}_{4})}{c(Ba{\;}^{2+})}$,PbCrO4溶液中c(CrO42-)=$\frac{Ksp(PbCrO{\;}_{4})}{c(Pb{\;}^{2+})}$,Ag2CrO4溶液中c(CrO42-)=$\frac{Ksp(Ag{\;}_{2}CrO{\;}_{4})}{c(Ag{\;}^{+}){\;}^{2}}$,c(CrO42-)越小,先生成沉淀;
(4)根据K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$进行计算;
(5)根据两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为 ,则两个CrO42-每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个CrO42-通过角顶氧原子连续的链式,则少n-1个氧原子,据此书写;
,则两个CrO42-每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个CrO42-通过角顶氧原子连续的链式,则少n-1个氧原子,据此书写;
(6)设三氧化铬的质量为100g,则生成固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{76-52}{16}$=2:3,由此确定生成物的化学式书写方程式.
解答 解:(1)因为化合物化合价代数和为0,又化学式Na3CrO8中阴离子结构可表示为 ,则氧为-1价,钠为+1价,所以铬为+5,故答案为:+5;
,则氧为-1价,钠为+1价,所以铬为+5,故答案为:+5;
(2)因为观察到Cu电极上产生大量的无色气泡即右侧为正极有氢气生成,Cr电极周围出现天蓝色(Cr2+,而后又变成绿色 (Cr3+),说明铬先失电子生成二价铬,后又失电子生成三价铬,所以电池总反应的过程表示为Cr+2H+=Cr2++H2↑,2Cr2++2H+=2Cr3++H2;又阴离子移向阴极,所以左侧烧杯溶液中c(Cl-)增大;故答案为:Cr+2H+=Cr2++H2↑;增大;
(3)析出沉淀时,BaCrO4溶液中c(CrO42-)=$\frac{Ksp(BaCrO{\;}_{4})}{c(Ba{\;}^{2+})}$=$\frac{1.2×10{\;}^{-10}}{0.01}$=1.2×10-8mol/L,PbCrO4溶液中c(CrO42-)=$\frac{Ksp(PbCrO{\;}_{4})}{c(Pb{\;}^{2+})}$=$\frac{2.8×10{\;}^{-13}}{0.01}$=2.8×10-11mol/L,Ag2CrO4溶液中c(CrO42-)=$\frac{Ksp(Ag{\;}_{2}CrO{\;}_{4})}{c(Ag{\;}^{+}){\;}^{2}}$=$\frac{2.0×10{\;}^{-12}}{0.01{\;}^{2}}$=2×10-8mol/L,因为c(CrO42-)越小,先生成沉淀,所以三种阳离子产生沉淀的先后顺序为Pb2+、Ba2+、Ag+,故答案为:Pb2+、Ba2+、Ag+;
(4)2CrO42-+2H+?Cr2O72-+H2O的平衡常数K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$=$\frac{{K}_{1}{\;}^{2}}{K}$=$\frac{(10{\;}^{5.9}){\;}^{2}}{10{\;}^{-2.2}}$=1014,故答案为:1014;
(5)由两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为 ,则两个CrO42-每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个CrO42-通过角顶氧原子连续的链式,则少n-1个氧原子,则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-,故答案为:CrnO(3n+1)2-;
,则两个CrO42-每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个CrO42-通过角顶氧原子连续的链式,则少n-1个氧原子,则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-,故答案为:CrnO(3n+1)2-;
(6)由CrO3加热至790K时,残留固体的质量为原固体质量76%,设三氧化铬的质量为100g,则生成固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{76-52}{16}$=2:3,所以生成的固体的成分是Cr2O3,则反应方程式为:4CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑,
故答案为:4CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑.
点评 本题考查了电解反应式的书写、沉淀溶解平衡Ksp的有关计算、氧化还原反应方程式的书写等,同时考查学生获取信息、加工信息能力,需要学生具备扎实的基础,题目难度中等.

| A. | Na+K+OH-Cl- | B. | Na+Cu2+SO42-NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
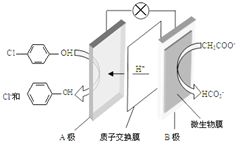 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(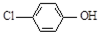 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| B. | A极的电极反应式为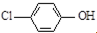 +e-═Cl-+ +e-═Cl-+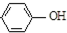 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )| 制取气体 | 实验药品 | 收集气体方法 | |
| A | 二氧化碳 | 碳酸钙、稀硫酸 | 排饱和碳酸氢钠溶液 |
| B | 氧气 | 双氧水、二氧化锰 | 排水法 |
| C | 氨气 | 氧氡化钠溶液、浓氨水 | 向下排空气法 |
| D | 乙烯 | 氯乙烷,氢氧化钠、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 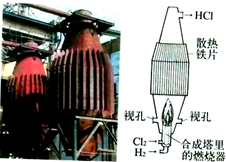 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热,然后加入AgNO3溶液 | |
| D. | 加入热的NaOH醇溶液,充分反应后,加入稀硝酸酸化,再加入AgNO3溶液 |
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |


