题目内容
1.“三酸二碱”在化工生产中有着重要的应用.下列说法正确的是( )| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
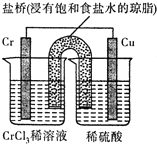
| B. | 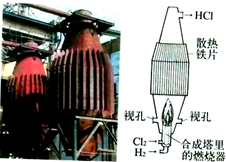 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
分析 A.常压下二氧化硫的转化率已很高;
B.氯气和氢气的通入位置错误;
C.工业用电解饱和食盐水制备氯气和氢氧化钠;
D.工业用氮气、水、碳为原料制备氨气,可生成二氧化碳等.
解答 解:A.接触室中不需要高压空气,采用过量常压空气即可,故A错误;
B.氢气和氯气的顺序颠倒,因为氯气有剧毒,将氢气从上面通入可以预防由于万一氯气泄漏而造成的中毒事故,故B错误;
C.海水含杂质,应首先净化,工业用电解饱和食盐水制备氯气和氢氧化钠,故C错误;
D.合成氨工业是可为后两者可提供氨气和二氧化碳,故D正确.
故选D.
点评 本题考查常见物质的工业制备,为高频考点,侧重于化学与生产的考查,注意把握反应的原理以及条件,难度不大,注意相关知识的积累.

练习册系列答案
相关题目
16.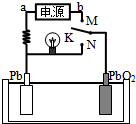 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
20.己知浓硝酸和乙胺反应:CH3CH2NH2+HNO3=CH3CH2NH3.NO3,产物 CH3CH2NH3•NO3的熔点为12℃,在室温下能够融化电离出CH3CH2NH3+和NO3-离子,称为室温离子.下列有关正确的是( )
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
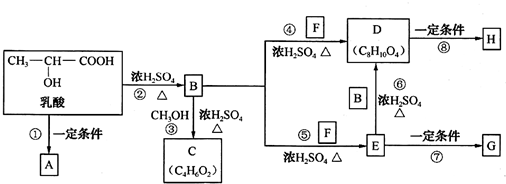
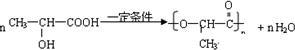 .
.
 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: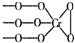 ,则Cr的化合价为+5.
,则Cr的化合价为+5.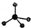 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为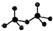 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
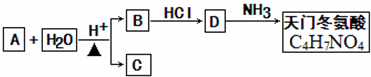
 +2H2O.
+2H2O.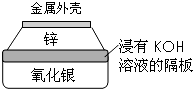 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.