3. 咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
 咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )| A. | 该物质中苯环上一氯化物有2种 | |
| B. | 所有碳原子不可能都在同一平面上 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 1mol该物质可以与1.5mol碳酸钠溶液反应生成1.5molCO2 |
2.化学与社会、生活密切相关,下列说法正确的是( )
| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
1.下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
20.下列叙述中指定粒子数目一定大于NA的是( )
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
19.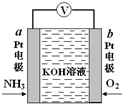 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
18.邻苯二甲酸二乙酯是增塑剂,其结构简式如图,关于该物质的说法中正确的是( )
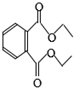

| A. | 该物质能使溴的四氯化碳溶液褪色 | |
| B. | 其分子式为C12H15O4 | |
| C. | 该物质完全水解能生成三种产物 | |
| D. | 1mol该物质与足量NaOH溶液反应能消耗2molNaOH |
17.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是( )
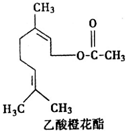

| A. | 分子式为C12H20O2 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成反应,但不能发生取代反应 | |
| D. | 1mol该有机物水解时只能消耗lmolNaOH |
16.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
15.利用下列实验装置进行的相应实验,能达到实验目的是( )
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
14.已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
①25℃时,浓度均为0.1mol•L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是Na2CO3>NaCN>CH3COONa>Na2C2O4.中和等体积、等pH的HCOOH和HCN消耗NaOH的量后者大(填“前者大”“后者大”或“相等”).
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
0 168661 168669 168675 168679 168685 168687 168691 168697 168699 168705 168711 168715 168717 168721 168727 168729 168735 168739 168741 168745 168747 168751 168753 168755 168756 168757 168759 168760 168761 168763 168765 168769 168771 168775 168777 168781 168787 168789 168795 168799 168801 168805 168811 168817 168819 168825 168829 168831 168837 168841 168847 168855 203614
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.