题目内容
20.下列叙述中指定粒子数目一定大于NA的是( )| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
分析 A.苯分子不存在碳碳双键;
B.1mol CaC2固体含有1molC22-离子;
C.CH3COOH溶液中含有CH3COOH分子及大量水分子;
D.1mol Cl2参加化学反应获得的电子数可能为1mol,如反应Cl2+H2O=HCl+HClO.
解答 解:A.苯分子中不存在碳碳双键,故A错误;
B.1mol CaC2固体含有1molC22-离子,阴离子总数为NA,故B错误;
C.CH3COOH溶液中含有CH3COOH分子及大量水分子,1L 1mol/L CH3COOH溶液中所含分子总数一定大于NA,故C正确;
D.1mol Cl2参加化学反应获得的电子数可能为1mol,即获得电子数可能为NA,如反应Cl2+H2O=HCl+HClO,故D错误,
故选C.
点评 本题考查物质的量有关计算,涉及物质的组成、化学键、氧化还原反应等,C、D选项为易错点,C中学生容易忽略溶液中水分子,D中学生容易认为氯气全部其氧化剂作用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.相关物质的溶度积常数见下表(25℃):
下列有关说法中不正确的是( )
| 物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
| Ksp(单位略) | 1.1×10-11 | 2.3×10-3 | 1.8×10-10 | 1.9×10-12 |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将O.001 mol•L-1的AgN03溶液滴入O.001 mol•L-1的KCl和O.001 mol•L-1 的K2CrO4混合溶液中.先产生Ag2Cr04沉淀 | |
| C. | 0.ll mol•L-1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
8.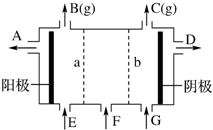 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
15.利用下列实验装置进行的相应实验,能达到实验目的是( )
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
5.化学与生活、生产密切相关.下列叙述正确的是( )
| A. | 硅胶和铁粉常用于食品包装袋中作抗氧化剂,它们都是无机物 | |
| B. | 食盐和食醋常用于厨房中作调味品,它们都是盐 | |
| C. | 硅和石英常用于制作光导纤维,它们都是原子晶体 | |
| D. | 氢氧化铝和碳酸氢钠常用于消除胃酸过多,它们都是电解质 |
9. 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )| A. | 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放电时OH-移向镍电极 | |
| C. | 充电时碳电极反应为H2-2e-+2OH-=2H2O | |
| D. | 充电时将碳电极与电源的正极相连 |
10.a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族.c原子核内质子数等于a、b原子核内质子数之和,c原子最外层上的电子数是d原子次外层电子数的一半.下列说法中正确的( )
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
