题目内容
19.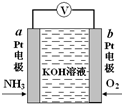 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
分析 NH3被氧化为常见无毒物质,应生成氮气,Pt电子通入氨气生成氮气,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.因为a极为负极,则溶液中的阴离子向负极移动,故A正确;
B.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故B错误;
C.氧气具有氧化性,在原电池中被还原,应为正极反应,故C正确;
D.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故D正确.
故选B.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
10. 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )| A. | a、b、c三点溶液的Kw相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
7.用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,关于电解过程说法不正确的是( )
| A. | 生成的铜的物质的量是0.2mol | B. | 随着电解进行溶液的pH减小 | ||
| C. | 转移电子的物质的量为0.4mol | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
14.已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
①25℃时,浓度均为0.1mol•L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是Na2CO3>NaCN>CH3COONa>Na2C2O4.中和等体积、等pH的HCOOH和HCN消耗NaOH的量后者大(填“前者大”“后者大”或“相等”).
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)
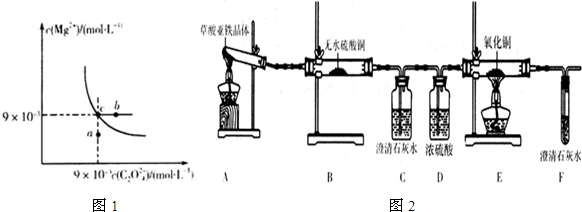
(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
11.下列关于各实验装置图的叙述中正确的是( )
| A. | 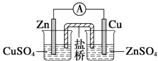 装置:构成锌-铜原电池 | |
| B. |  装置:实验室制氨气并收集干燥的氨气 | |
| C. | 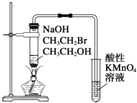 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 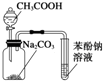 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
8.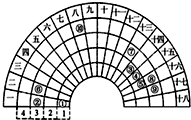 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
9.下列化学过程及其表述正确的是( )
| A. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH- $→_{加热}^{水浴}$ CH3COO-+Cu2O↓+3H2O | |
| B. | 苯酚与碳酸钠溶液反应:C6H5OH+CO32-→C6H5O-+HCO3- | |
| C. | 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol | |
| D. | 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性: 2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |

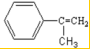

 ;反应⑦n
;反应⑦n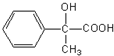 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$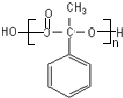 +(n-1)H2O
+(n-1)H2O