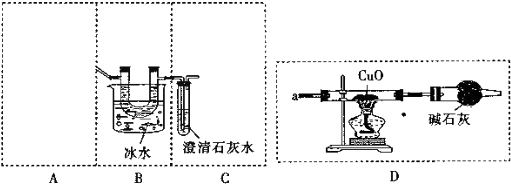
8.分类是学习和研究化学的一种重要方法.下列分类合理的是( )
| A. | HCl和H2SO4都属于酸 | B. | K2CO3和K2O都属于盐 | ||
| C. | NaOH和Na2CO3都属于碱 | D. | H2O和O2都属于氧化物 |
6.Ⅰ:图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失.

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
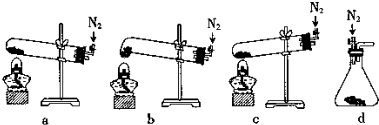
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
(2)由上述实验可得出的结论是:同周期元素从左到右金属性逐渐减弱
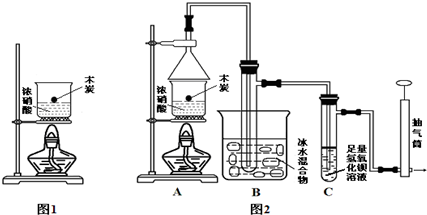
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
5.(1)氨催化氧化法是工业制硝酸的主要方法,可进行连续生产.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
①写出合成氨反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{3})}$
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).
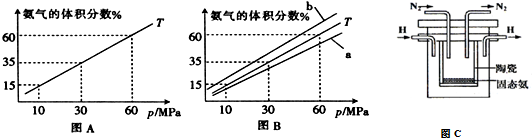
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).

A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
3.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取溶液进行连续实验,实验过程及产物如下:下列结论正确的是( )
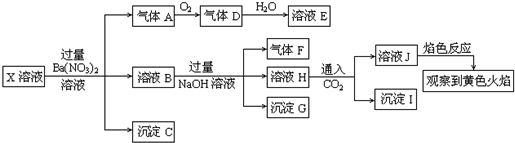

| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
1.根据下表信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的快慢为L<Q | ||
| C. | M与T形成的化合物是离子化合物 | D. | L2+与R2-的核外电子数相等 |
20. 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
请回答下列问题:
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
19.某学习小组利用图1装置制取乙酸乙酯.
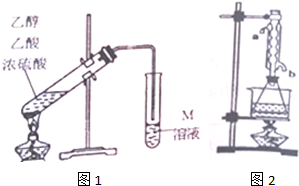
请回答下列问题:
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.
0 168637 168645 168651 168655 168661 168663 168667 168673 168675 168681 168687 168691 168693 168697 168703 168705 168711 168715 168717 168721 168723 168727 168729 168731 168732 168733 168735 168736 168737 168739 168741 168745 168747 168751 168753 168757 168763 168765 168771 168775 168777 168781 168787 168793 168795 168801 168805 168807 168813 168817 168823 168831 203614

| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.