题目内容
8.分类是学习和研究化学的一种重要方法.下列分类合理的是( )| A. | HCl和H2SO4都属于酸 | B. | K2CO3和K2O都属于盐 | ||
| C. | NaOH和Na2CO3都属于碱 | D. | H2O和O2都属于氧化物 |
分析 A、水溶液中电离出的阳离子全部是氢离子的化合物为酸;
B、金属阳离子和酸根阴离子构成的化合物为盐;
C、水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱;
D、两种元素组成其中一种是氧元素的化合物为氧化物.
解答 解:A、HCl和H2SO4电离出的阳离子全部是氢离子都属于酸,故A正确;
B、K2CO3是盐,K2O属于氧化物不是盐,故B错误;
C、NaOH属于碱,Na2CO3属于盐,不是碱,故C错误;
D、H2O属于氧化物,O2是单质不是氧化物,故D错误;
故选A.
点评 本题考查了物质分类方法和物质组成的理解应用,注意名称和化学式组成的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.能够证明乙醇分子(C2H6O)组成的最充分的理由是( )
| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol氢气 | |
| B. | 1mol乙醇充分燃烧生成2mol CO2和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol乙醇氧化后生成1mol乙醛 |
16.利用铜萃取剂M,通过如图甲所示反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
(6)某Y原子的价电子排布式是3s23p5,铜与Y形成的化合物的晶胞结构如图丙;
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).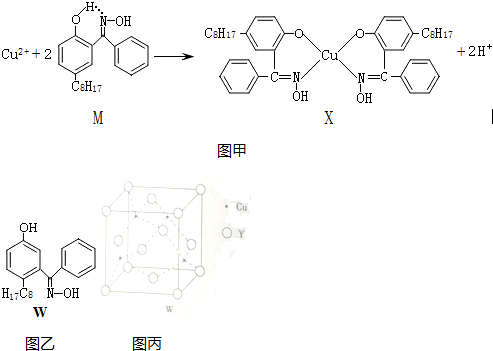
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).

3.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取溶液进行连续实验,实验过程及产物如下:下列结论正确的是( )
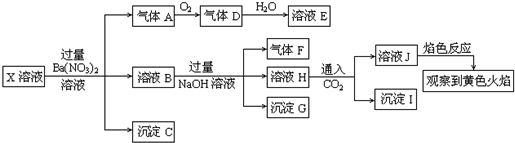

| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
13.同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A. | H与D | B. | CH3CH2OH与CH3COOH | ||
| C. | CH≡CH与C6H6 | D. | CH3CH2CH2CH3与 |
18.两种物质间反应生成相同物质的量的气体时,消耗酸的物质的量最少的是( )
| A. | 碳与浓硝酸 | B. | 铜与稀硝酸 | ||
| C. | 二氧化锰与浓盐酸 | D. | 铝与稀盐酸 |
 青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.
青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.