题目内容
7.乙二酸通常以二水合物的形式存在,倍称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会发生分解反应.(1)下列关于乙二酸的叙述正确的是①②③④.(填序号)
①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氨钠溶液反应生成气体
(2)欲检验草酸晶体受热分解的产物中是否有 CO2,设计实验如下:
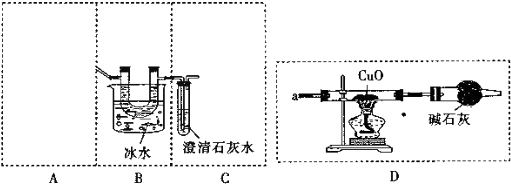
①装置最好应该选择下列装置中的b(填序号)
②简述检验整套装置气密性的操作方法:如图连接好装置,关闭装置A的活塞,将C装置中的导管没入水中,微热A装置的试管,看到导气管口处有气泡冒出,撤火后观察到导气管中有一段水柱上升,则说明装置气密性完好.
③若无B装置,当c装置中出现浑浊不能(填“能”或“不能”)证明草酸分解生成了CO2,理由是草酸和氢氧化钙也反应生成草酸钙白色沉淀.
(3)若上述装置C中盛放Ba(OH)2 溶液,导气管与D装置中的a相连,通过测定C中生成沉淀的质量,装置D中硬质玻璃管减少的质量,即可确定草酸分解的化学方程式.
①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水的原因是Ba(OH)2 溶解度大于氢氧化钙可充分吸收二氧化碳,碳酸钡摩尔质量大于碳酸钙,测量误差小.
②当A装置试管中只有较步晶体时停止加热,利用余热使晶体升华、分 解,此时需要缓缓通入N2,通入N2 的目的是使草酸分解生成的气体全部钡装置CD全部吸收.
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,装置D中硬质玻璃管减少的质量为1.6g,则草酸分解的化学方程式为H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
分析 (1)乙二酸分子中含有羧基,有酸性能发生酯化反应、能被高锰酸钾氧化;
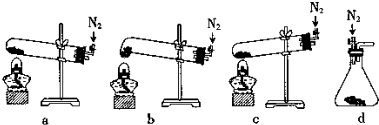
(2)①由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验,能避免熔融的草酸流进导管而影响后续实验;
②装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好;
③草酸晶体在101℃时熔化并开始升华,157℃时大量升华,草酸和氢氧化钙也反应生成草酸钙白色沉淀分析;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氢氧化钡溶解度大于氢氧化钙,利用的是氢氧化钡吸收二氧化碳充分,碳酸钡摩尔质量大于碳酸钙,测得误差小;
②缓缓通入N2,把生成的气体全部赶入CD中全部吸收,减少测得误差;
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,为碳酸钡沉淀,计算得到二氧化碳中碳元素物质的量,装置D中硬质玻璃管减少的质量为1.6g,说明生成了一氧化碳,依据反应定量关系计算一氧化碳物质的量,依据碳元素守恒得到草酸晶体中草酸质量,得到含有结晶水的质量,依据原子守恒计算书写化学方程式;
解答 解:(1)乙二酸分子中含有羧基,具有酸性,且酸性比碳酸强,能使蓝色石蕊试液变红,能与碳酸氢钠反应生成二氧化碳;能与乙二醇发生发生酯化反应;能被酸性高锰酸钾氧化而使高锰酸钾溶液褪色,所以四个选项都正确,
故答案为:①②③④;
(2)①由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验,能避免熔融的草酸流进导管而影响后续实验,装置最好应该选择下列装置中的b,
故答案为:b;
②装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好,如图连接好装置,关闭装置A的活塞,将C装置中的导管没入水中,微热A装置的试管,看到导气管口处有气泡冒出,撤火后观察到导气管中有一段水柱上升,则说明装置气密性完好,
故答案为:装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好;
③草酸晶体在101℃时熔化并开始升华,157℃时大量升华,草酸和氢氧化钙也反应生成草酸钙白色沉淀分析,若无B装置,当c装置中出现浑浊,不能说明草酸分解生成了CO2,
故答案为:不能;草酸和氢氧化钙也反应生成草酸钙白色沉淀;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氢氧化钡溶解度大于氢氧化钙,利用的是氢氧化钡吸收二氧化碳充分,碳酸钡摩尔质量大于碳酸钙,测得误差小,
故答案为:Ba(OH)2 溶解度大于氢氧化钙可充分吸收二氧化碳,碳酸钡摩尔质量大于碳酸钙,测量误差小;
②缓缓通入N2,把生成的气体全部赶入CD中全部吸收,减少测得误差,
故答案为:使草酸分解生成的气体全部钡装置CD全部吸收;
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,为碳酸钡沉淀物质的量=$\frac{19.7g}{197g/mol}$=0.1mol,计算得到二氧化碳中碳元素物质的量为0.1mol,装置D中硬质玻璃管减少的质量为1.6g,减少的是氧元素质量,物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,依据反应定量关系计算一氧化碳物质的量,说生成了一氧化碳为0.1mol,依据碳元素守恒得到草酸晶体中草酸质量=(0.1mol+0.1mol)×$\frac{1}{2}$×90g/mol=9g,得到含有结晶水的质量=15g-9g=6g,水的物质的量=$\frac{6g}{18g/mol}$=$\frac{1}{3}$mol,n(CO2):n(CO):n(H2O)=0.1:0.1:$\frac{1}{3}$≈1:1:3,依据原子守恒计算书写化学方程式:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑,
故答案为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
点评 本题通过探讨乙二酸的性质,考查了物质性质实验方案的设计,题目难度较大,正确理解题干信息明确反应原理为解答关键,计算过程稍复杂,可以假设出草酸氢铵的物质的量,然后根据反应原理计算,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
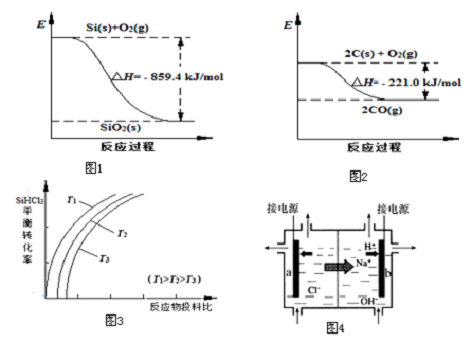
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用蒸馏(或分馏)方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是ac(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是精制的饱和食盐水,b电极上的电极反应式是2H++2e-═H2↑.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=4.
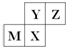
| A. | 四种元素中,最高价氧化物的水化物酸性:Z的最强 | |
| B. | 氢化物稳定性:Y的最强 | |
| C. | 原子半径由小到大顺序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失电子最多,其单质的还原性最强 |


