��Ŀ����
4����ѧʵ��װ�õĿ�ѧ�����ʵ���Ƿ�ȡ��Ԥ��Ч���Ĺؼ���ijʵ��С����̽��̼��Ũ���ᷴӦ���������ͬѧ�����ͼ1װ�ã���Ϊ���к���ɫ���������˵��̼��Ũ���ᷢ���˷�Ӧ��
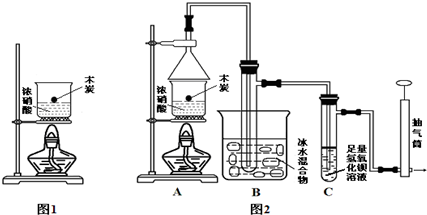
��1��̼��Ũ���ᷴӦ�ķ���ʽC+4HNO3 ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+CO2��+2H2O����ͬѧ��ʵ��Ӧ����ͨ����н��У��ŷ��ϻ�ѧʵ�鰲ȫ�Ե�Ҫ��
��2����ͬѧ��Ϊ����ɫ���岻һ����̼��Ũ���ᷢ����Ӧ���ã���������Ϊ��ͬѧ�۵��Ǵ���ģ�����������4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O���û�ѧ����ʽ��ʾ������������ΪӦ�ü���CO2���ѧʽ���IJ�����֤��̼��Ũ���ᷴӦ��Ϊ����ͬѧ����������ϵ�֪��0��ʱ����������ΪҺ�塱���Ӷ��Ľ���ʵ��װ����ͼ2��ʾ��
��3������ƽ���ƶ�ԭ������Bװ�õ����ó����´���ƽ����ϵ��2NO2?N2O4�������¶�N2O4Һ����ƽ�����ƣ���ȥ��������е�NO2����Ϸ���ʽ�����ֱ�������
��4��Cװ���г��ֵ�������C����Һ����ǣ��������ɫ�������������C����Һ�л�����������Ԫ�أ�ֻ��NO3-��ʽ���ڣ�д�����ɸ����ӵ����ӷ���ʽ4NO2+O2+4OH-=4NO3-+2H2O��
���� ��1��̼��Ũ���ᷴӦ���ɶ�����̼������������ˮ�����������ж���
��2��Ũ����ȶ��������ֽ⣻Ҫ����÷�Ӧ������Ҫ���������̼��
��3���¶ȵͣ�ƽ�������������������ķ����ƶ���
��4��������̼�ܺ�����������Һ��Ӧ���������Ե�̼�ᱵ������������������ˮ��Ӧ�������ᣬ���������������������кͷ�Ӧ��
��� �⣺��1��̼��Ũ���ᷴӦ�ķ���ʽΪC+4HNO3 ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+CO2��+2H2O�����������ж������ͬѧ��ʵ��Ӧ����ͨ����н��У��ŷ��ϻ�ѧʵ�鰲ȫ�Ե�Ҫ��
�ʴ�Ϊ��C+4HNO3 ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+CO2��+2H2O��ͨ�����
��2��Ũ����ȶ��������ֽ����ɶ���������Ũ�����̼�ڼ��������·�ӦҲ���ɶ������������Զ�ʵ����ɸ��ţ���Ӧ����ʽΪ4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O������Ҫ�����Ũ�����̼��Ӧ���ܸ����Ƿ����ɶ��������жϣ�Ҫ����CO2�жϣ�
�ʴ�Ϊ��4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O��CO2��
��3�����������Ϣ֪��0��ʱ����������ΪҺ�壬�����¶�Խ�ͣ���������Խ�����������������ƶ�������Ҫʹ�ñ�ˮ�������ȴ�����������壬�Ӷ�����������еĶ���������ȥ����ֹ������̼�ļ��飬
�ʴ�Ϊ�������´���ƽ����ϵ��2NO2?N2O4�������¶�N2O4Һ����ƽ�����ƣ���ȥ��������е�NO2��
��4������̼�ܺ�����������Һ��Ӧ���������Ե�̼�ᱵ�����Կ����������ǣ�C����Һ����ǣ�����������������ˮ��Ӧ�������ᣬ���������������������кͷ�Ӧ��������Һ�ʳ�����������ӣ���Ӧ����ʽΪ4NO2+O2+2Ba��OH��2=2Ba��NO3��2+2H2O�����ӷ�ӦΪ4NO2+O2+4OH-=4NO3-+2H2O��
�ʴ�Ϊ��C����Һ����ǣ��������ɫ��������4NO2+O2+4OH-=4NO3-+2H2O��
���� ���⿼������ʵ�鷽������ƣ�Ϊ��Ƶ���㣬����ͼ��װ�õ����á���Ӧԭ����ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ���������ۺϿ��飬��Ŀ�Ѷ��еȣ�

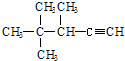 ��ϵͳ����Ϊ��������
��ϵͳ����Ϊ��������| A�� | 2��2��3-����-1-��Ȳ | B�� | 3��4��4-����-4-��Ȳ | ||
| C�� | 3��4��4-����-1-��Ȳ | D�� | 2��2��3-����-4-��Ȳ |
| A�� | pH=4���Ȼ����Һ��������ˮϡ��10������Һ��pH=5 | |
| B�� | pH=3��������pH=3��CH3COOH��Һ��ȣ�c��Cl-����C��CH3COO-�� | |
| C�� | pH=2��һԪ��HA��Һ��pH=12��NaOH��Һ�������1��1��Ϻ�c��Na+����c��A-�� | |
| D�� | pH��ͬ��NaOH��NaClO������Һ��ˮ�ĵ���̶���ͬ |
| ��Է������� | �е㣨�棩 | |
| �Ҵ� | 46 | 78.5 |
| ���� | 60 | 117.9 |
| �������� | 88 | 77.1 |
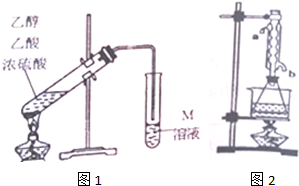
��1����ͼ1��ȡװ����Ҫ�������Ƭ���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������C������ȷѡ����ĸ����
A���������� B�������Ӳ� C����ȴ��Ӳ� D������Ӳ�
��2��M��ҺΪNa2CO3���ѧʽ����Һ��װ����ͨ�����ĵ���Ҫ���ڱ���M��Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ���Ƿ�ֹM��Һ��������ɵ�����ԭ����������Ҵ���������Na2CO3��Һ��
��3����ͬѧ��Ϊ�Ľ�ͼ1����ȡװ������������������ʣ�д��һ���Ľ����飺��װˮ�����ܣ������ȴЧ������Բ����ƿ��������ƿ������װ�¶ȼƿ��Ʒ�Ӧ�¶ȣ�
��4��ͼ1װ����ȡ�����������л��������Ҵ������ᣮͨ������ʵ��ɷ������������ĺ����������������£�
��ȷ����20.0g���������ֲ�Ʒ����ƿ�У���0.50mol•L-1NaOH�ζ�����̪��ָʾ�������յ�ʱ����NaOH��Һ�����Ϊ40.0mL
����ȡ20.0g���������ֲ�Ʒ��250mL��ƿ�У�����100mL2.1mol•L-1NaOH��Һ��Ͼ��Ⱥ�װ�������ܣ���ˮԡ�ϼ��Ȼ���Լ1Сʱ��װ����ͼ2��ʾ��������ȴ����0.50mol•L-1HCl�ζ�������NaOH���յ�ʱ������������Ϊ20.0mL��ʵ�������ˮ�������ܵ�b��ѡ��a��b���ܿ�ͨ�룮����ʵ��١��ڲ��������ݼ���ֲ�Ʒ��������������������Ϊ79.2%��
| A�� | +7 | B�� | +5 | C�� | +3 | D�� | -7 |
| A�� | ��ѧ��Ӧ�����DZ�ʾ��ѧ��Ӧ������������ | |
| B�� | һ������£������¶��ܼӿ컯ѧ��Ӧ���� | |
| C�� | ���淴Ӧ�ﵽ��ѧ��Ӧ��ʱ����Ӧ�;�ֹ������ | |
| D�� | ���淴Ӧ�ﵽ��ѧ��Ӧ��ʱ������Ӧ���ʵ����淴Ӧ���� |
A��NaOH B��Na2SO4 C��NH4Cl
�Իش��������⣺
����Һ��H+��OH-Ũ�ȱ仯���������������١��������䡱����
��c��H+���� c��OH-����С�Ƚϣ������������������=������
����Һ������ԣ�����ԡ��������ԡ��������ԡ�����
�밴����Ҫ����������������ݣ�
| A��NaOH | B��Na2SO4 | C��NH4Cl | |
| c��H+�� | ��С | �� | �� �� |
| c��OH-�� | �� | �� �� | �� |
| c��H+����c��OH-���Ĵ�С�Ƚ� | �� | = | �� |
| ��Һ������� | �� �� | �� | �� �� |
�ٸ÷�Ӧ���Ȼ�ѧ������ʽΪN2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol
�ڸ÷�Ӧ�ﵽƽ��������¶�ƽ������ ������������桱����Ӧ�����ƶ�������ѹǿƽ������ ������������桱����Ӧ�����ƶ����������ƽ�ⲻ�ܣ���ܡ��������ܡ����ƶ���
��ǰ2s��v��H2��Ϊ0.15mol/��L•s����
| A�� | ${\;}_{8}^{18}$O2��${\;}_{8}^{16}$O2��ͬ���칹�� | |
| B�� | ${\;}_{8}^{18}$O2��O3��һ��ͬ�������� | |
| C�� | ${\;}_{8}^{18}$O2��${\;}_{8}^{16}$O2��Ϊͬλ�� | |
| D�� | 1mol ${\;}_{8}^{18}$O2�������20mol���� |
 �Ķ��ȴ�����4�֣�
�Ķ��ȴ�����4�֣�