题目内容
1.根据下表信息,判断以下叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的快慢为L<Q | ||
| C. | M与T形成的化合物是离子化合物 | D. | L2+与R2-的核外电子数相等 |
分析 短周期元素中,R、T都有-2价,原子半径R>T,故R为S元素、T为O元素,L、Q元素有+2,处于ⅡA族,L原子半径较大,故L为Mg、Q为Be;M化合价为+3价,处于ⅢA族,原子半径介于Mg与S之间,M为Al.
A.水分子之间存在氢键,沸点较高;
B.金属性越强,金属与酸反应越剧烈;
C.氧化铝属于离子化合物;
D.核外电子数=质子数-离子带的电荷.
解答 短周期元素中,R、T都有-2价,原子半径R>T,故R为S元素、T为O元素,L、Q元素有+2,处于ⅡA族,L原子半径较大,故L为Mg、Q为Be;M化合价为+3价,处于ⅢA族,原子半径介于Mg与S之间,M为Al.
A.水分子之间存在氢键,沸点较高,故A错误;
B.金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故B错误;
C.M与T形成的化合物是氧化铝,属于离子化合物,故C正确;
D.Mg2+的核外电子数为12-2=10,S2-的核外电子数为16-(-2)=18,核外电子数不相等,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,根据原子半径及化合价来推断元素是解题的关键,熟悉掌握同周期、同主族元素性质递变规律,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
9.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| B. | 研发易降解的生物农药有利于环境保护 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 常用无水酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
16.利用铜萃取剂M,通过如图甲所示反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
(6)某Y原子的价电子排布式是3s23p5,铜与Y形成的化合物的晶胞结构如图丙;
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).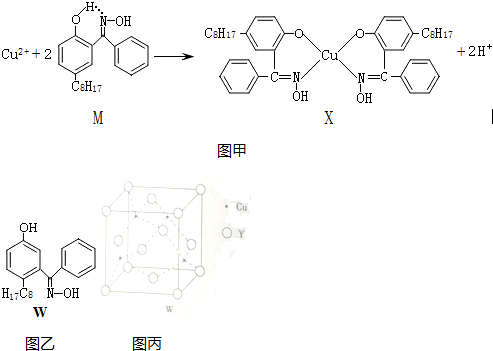
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).

6.Ⅰ:图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失.

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
(2)由上述实验可得出的结论是:同周期元素从左到右金属性逐渐减弱
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
13.同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A. | H与D | B. | CH3CH2OH与CH3COOH | ||
| C. | CH≡CH与C6H6 | D. | CH3CH2CH2CH3与 |
10.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
11.下列叙述正确的是 ( )
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |

 ,丁
,丁 .
. .
.