9.下列反应与4H2O2+PbS→PbSO4+4H2O相比较,H2O2的作用相同的是( )
| A. | H2O2+SO2→H2SO4 | |
| B. | 3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O | |
| C. | 2H2O2→2H2O+O2↑ | |
| D. | H2O2+2FeCl3→2FeCl2+2HCl+O2↑ |
8.反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )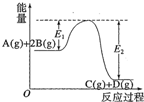

| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
7.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
6.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
5.根据有机物的命名原则,下列命名正确的是( )
| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 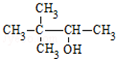 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
4.近年来,我国大力倡导使用乙醇汽油.关于乙醇汽油与普通汽油,下列说法正确的是( )
0 168592 168600 168606 168610 168616 168618 168622 168628 168630 168636 168642 168646 168648 168652 168658 168660 168666 168670 168672 168676 168678 168682 168684 168686 168687 168688 168690 168691 168692 168694 168696 168700 168702 168706 168708 168712 168718 168720 168726 168730 168732 168736 168742 168748 168750 168756 168760 168762 168768 168772 168778 168786 203614
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
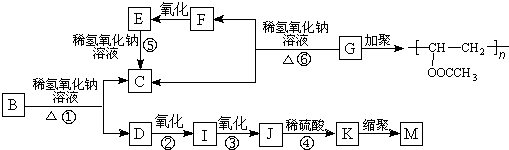
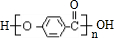 .
. +3NaOH
+3NaOH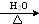 CH3COONa+
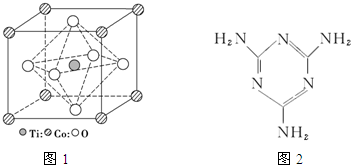
CH3COONa+ +NaBr+H2O.
+NaBr+H2O.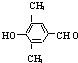 、
、 .
. MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.