题目内容
9.下列反应与4H2O2+PbS→PbSO4+4H2O相比较,H2O2的作用相同的是( )| A. | H2O2+SO2→H2SO4 | |
| B. | 3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O | |
| C. | 2H2O2→2H2O+O2↑ | |
| D. | H2O2+2FeCl3→2FeCl2+2HCl+O2↑ |
分析 根据4H2O2+PbS→PbSO4+4H2O反应,H2O2中氧的化合价由-1降低到-2体现氧化性,
A、H2O2+SO2→H2SO4反应中H2O2中氧的化合价由-1降低到-2体现氧化性;
B、3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O反应中H2O2中氧的化合价由-1降低到-2体现氧化性;
C、2H2O2→2H2O+O2↑反应中H2O2中氧的化合价部分由-1降低到-2部分由-1升高到0价,所以即体现氧化性又体现还原性;
D、H2O2+2FeCl3→2FeCl2+2HCl+O2↑反应中H2O2中氧的化合价由-1升高到0价,体现还原性;
解答 解:根据4H2O2+PbS→PbSO4+4H2O反应,H2O2中氧的化合价由-1降低到-2体现氧化性,
A、H2O2+SO2→H2SO4反应中H2O2中氧的化合价由-1降低到-2体现氧化性,所以符合条件,故A正确;
B、3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O反应中H2O2中氧的化合价由-1降低到-2体现氧化性,所以符合条件,故B正确;
C、2H2O2→2H2O+O2↑反应中H2O2中氧的化合价部分由-1降低到-2部分由-1升高到0价,所以即体现氧化性又体现还原性,所以不符合条件,故C错误;
D、H2O2+2FeCl3→2FeCl2+2HCl+O2↑反应中H2O2中氧的化合价由-1升高到0价,体现还原性,所以不符合条件,故C错误;
故选:AB;
点评 本题主要考查了氧化还原反应中物质的作用,难度不大,抓住化合价变化分析即可.

练习册系列答案
相关题目
4.近年来,我国大力倡导使用乙醇汽油.关于乙醇汽油与普通汽油,下列说法正确的是( )
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
14.化学与生产、生活密切相关.下列说法中正确的一项是( )
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
1.解释下列实验事实的离子方程式中,不准确的是( )
| A. | 在Na2SO4溶液中滴入Ba(OH)2溶液,产生白色沉淀:Ba2++SO42-=BaSO4↓ | |
| B. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O=O2↑+4OH-+4Na+ | |
| C. | 向Cl2水中滴入适量Fe(NO3)2 溶液,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I-+2H+=I2+2H2O |
18.下列排序正确的是( )
| A. | 微粒半径:Cl->K+>Al3+>O2- | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 晶体熔点:金刚石>氯化镁>汞>碘 | D. | 稳定性和还原性:H2O>H2S>AsH3 |
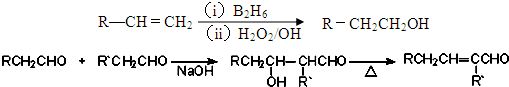
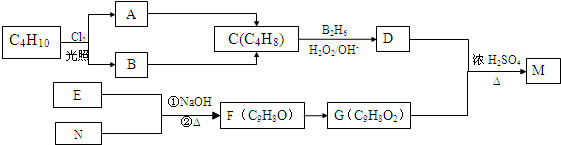
 、
、 ;
;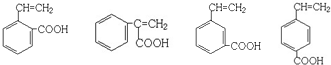 .
.