题目内容
2. MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.(1)写出基态Mn原子的核外电子排布式1s22s22p63s23p63d54s2.
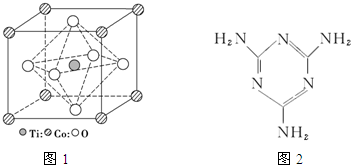
(2)CoTiO3晶体结构模型如图1.在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为6个、12个.
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理.O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子、离子化学式分别为CO2(或N2O、CS2、BeCl2等,合理均可)、N3-(各写一种).
(4)三聚氰胺是一种含氮化合物,其结构简式如图2.三聚氰胺分子中氮原子轨道杂化类型是sp2、sp3;1mol三聚氰胺分子中σ键的数目为15NA.三聚氰胺的相对分子质量与硝基苯的相近,但三聚氰胺的熔点比硝基苯的高,其原因是由于分子间形成氢键.
分析 (1)Mn是25号元素,其原子核外有25个电子,根据构造原理书写其基态原子核外电子排布式;
(2)在CoTiO3晶体中,1个Ti原子周围距离最近的O原子个数是6,1个Co原子周围距离最近的O原子数目=3×8÷2;
(3)原子个数相等、价电子数相等的微粒互为等电子体;
(4)氨基上N原子价层电子对个数是4且不含孤电子对、氮碳双键两端的N原子含有两个σ键和一个孤电子对,根据价层电子对理论判断原子杂化方式;
1个三聚氰胺分子中σ键个数是15,氢键导致物质的熔沸点升高.
解答 解:(1)Mn是25号元素,其原子核外有25个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d54s2,故答案为:1s22s22p63s23p63d54s2;
(2)在CoTiO3晶体中,1个Ti原子周围距离最近的O原子个数是6,1个Co原子周围距离最近的O原子数目=3×8÷2=12,故答案为:6;12;
(3)原子个数相等、价电子数相等的微粒互为等电子体,所以与CNO-互为等电子体的分子、离子化学式分别为CO2(或N2O、CS2、BeCl2等,合理均可)、N3-,故答案为:CO2(或N2O、CS2、BeCl2等,合理均可);N3-;
(4)氨基上N原子价层电子对个数是4且不含孤电子对,则N原子采用sp3杂化;氮碳双键两端的N原子含有两个σ键和一个孤电子对,N原子采用sp2杂化;
1个三聚氰胺分子中σ键个数是15,所以1mol三聚氰胺分子中σ键的数目为15NA,氢键导致物质的熔沸点升高,三聚氰胺分子间能形成氢键,导致其熔沸点高于硝基苯,
故答案为:sp2、sp3;15NA;由于分子间形成氢键.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氢键、原子杂化、等电子体、原子核外电子排布等知识点,侧重考查学生空间想象能力、计算能力及基本理论的掌握,难点是计算(2)题配位数,题目难度中等.

| A. | Na+的结构示意图为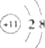 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | W分别与X、Y形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | Z的简单氢化物的热稳定性比W的强 |
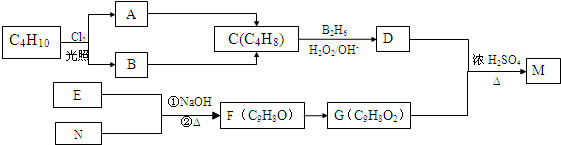
 、
、 ;
;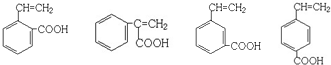 .
.
 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$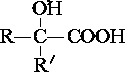 (R、R′代表烃基)
(R、R′代表烃基) $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.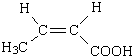 .
.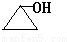 、
、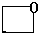 、
、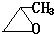 .
.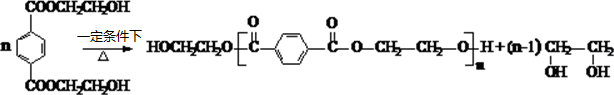 .
.