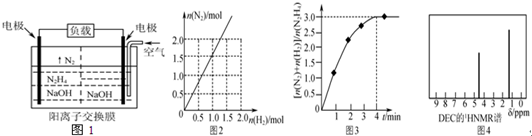
题目内容
8.反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )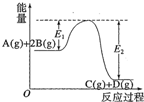
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
分析 A、反应热=反应物的总键能-生成物的总键能;
B、催化剂使正逆反应的活化能都降低;
C、升高温度,平衡向吸热方向移动;
D、因为该反应为可逆反应,1molA(g)和2molB(g)不可能反应到底.
解答 解:A、反应热=反应物的总键能-生成物的总键能,则-Q=E1-E2,故A错误;
B、催化剂使正逆反应的活化能都降低,反应速率加快,则E1减小,E2减小,故B错误;
C、Q>0,则该反应为放热反应,升高温度,平衡向吸热方向移动,所以平衡向逆方向移动,A的浓度增大,故C正确;
D、因为该反应为可逆反应,1molA(g)和2molB(g)不可能反应到底,所以1molA(g)和2molB(g)充分反应后放热小于QkJ,故D错误.
故选C.
点评 本题考查了反应热和焓变的分析判断,图象分析是解题关键,理解反应热的计算方法,注意知识积累,题目较简单.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
17.化学与生产生活息息相关.下列说法不正确的是( )
| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |


 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.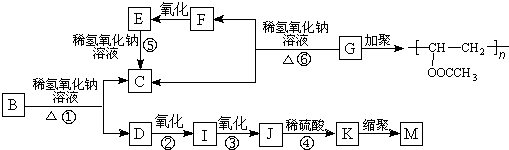
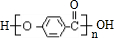 .
. +3NaOH
+3NaOH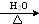 CH3COONa+
CH3COONa+ +NaBr+H2O.
+NaBr+H2O.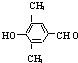 、
、 .
.

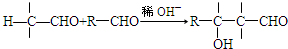

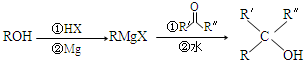
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式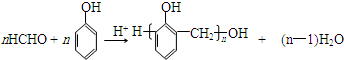 .
.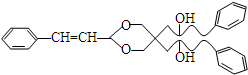 .
. .
.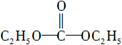 .
.