题目内容
6.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A、O、F无正价;
B、多电子原子中,在离核较近的区域内运动的电子能量较低;
C、因P、S、Cl同周期,且原子序数依次增大,则电子能力和最高价氧化物对应水化物的酸性均依次增强;
D、过渡元素包含副族元素与第Ⅷ族元素.
解答 解:A、O、F无正价,故A错误;
B、多电子原子中,在离核较近的区域内运动的电子能量较低,故B错误;
C、因P、S、Cl同周期,且原子序数依次增大,则电子能力和最高价氧化物对应水化物的酸性均依次增强,故C正确;
D、位于金属和非金属分界线附近的元素,表现一定的金属性与非金属性,而过渡元素包含副族元素与第Ⅷ族元素,故D错误,
故选C.
点评 本题考查结构性质位置关系的应用,难度不大,侧重对基础知识的巩固,A选项为易错点.

练习册系列答案
相关题目
11.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
18.如图为探究铁的性质的装置,装置中间的漏斗与空气相通,R为电源,则下列判断正确的是( )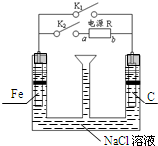

| A. | 若只关闭K1,则Fe发生析氢腐蚀 | |
| B. | 先只关闭K1,漏斗内液面下降,且有红褐色沉淀产生;再打开K1,仅关闭K2,则液面上升 | |
| C. | 若只关闭K2,只有一个电极产生气体,则a为电源负极 | |
| D. | 只关闭K1时,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2 |


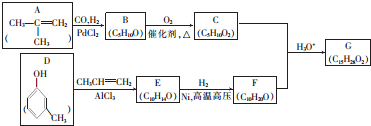
 反应可生成1mol百里酚酞
反应可生成1mol百里酚酞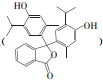
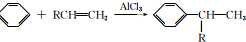
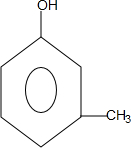 +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$ ;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.
;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.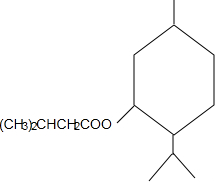 .
.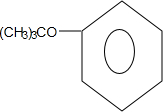 .
.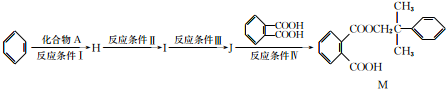
 .
.

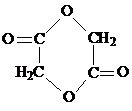 .
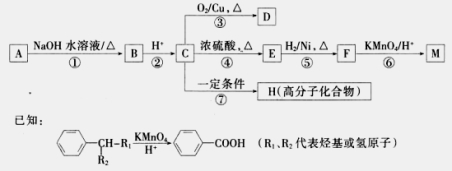
. .写出反应 ②的化学方程式
.写出反应 ②的化学方程式 .
.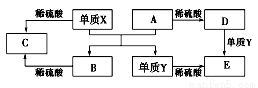
 Fe2O3+2Al
Fe2O3+2Al