题目内容
5.根据有机物的命名原则,下列命名正确的是( )| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 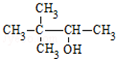 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
分析 A、从最简单的侧链按顺时针或逆时针给苯环上的碳原子进行编号,使侧链的位次和最小;
B、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号;
C、与-COOH直接相连的碳原子为α碳原子;
D、醇在命名时,要选含官能团的最长碳链为主链,从离官能团近的一端给主链上的碳原子进行编号.
解答 解:A、从最简单的侧链按顺时针或逆时针给苯环上的碳原子进行编号,使侧链的位次和最小,故名称为:1,3,5-三甲基苯,故A错误;
B、烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,从离支链近的一端给主链上的碳原子编号,则在3号碳原子上有一个甲基,故名称为:3-甲基己烷,故B错误;
C、与-COOH直接相连的碳原子为α-碳原子,而-NH2是连在β-碳原子上,故名称为:β-氨基丁酸,故C错误;
D、醇在命名时,要选含官能团的最长碳链为主链,故主链上有4个碳原子,从离官能团近的一端给主链上的碳原子进行编号,则-OH在2号碳原子上,在3号碳原子上有2个甲基,故名称为:3,3-二甲基-2-丁醇,故D正确.
故选D.
点评 本题考查了苯的同系物、烷烃、氨基酸和醇的命名,难度不大,注意基础的掌握.

练习册系列答案
相关题目
10.室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中溶液的描述正确的是( )
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
17.如表有关实验现象、解释和结论都正确的一项是( )
| 实验操作 | 实验现象 | 解释或结论 | |
| A | 加热(170℃)乙醇与浓硫酸混合物,将产生的气体直接通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫红色逐渐变浅 | 可能产生了SO2气体 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分为两层,下层是紫红色 | KI和氯水及苯发生反应 |
| C | 将少量SO2通入苯酚钠溶液中,振荡 | 溶液中出现浑浊 | 因为发生了反应: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把浓氨水加入到盛有Cu2O的试管中 | 溶液先无色,静置一段时间后变成蓝色 | Cu+被空气氧化成了Cu2+、使溶液显蓝色 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法不正确的是( )
| A. |  按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔 | |
| C. | 总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. |  化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合(pH=7): c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7): c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合: c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合: c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-) |
 CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。 CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。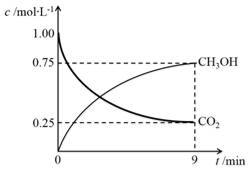

 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.